Несеминомная герминогенная опухоль
Содержание:
Герминогенные опухоли – группа неоплазий, развивающихся из первичных зародышевых клеток половых желез. Могут возникать как в яичках или яичниках, так и экстрагонадно. Проявления зависят от локализации. При поверхностно расположенных новообразованиях наблюдается видимая деформация, при узлах в яичнике отмечаются боли, дизурия и нарушения менструального цикла. При герминогенных опухолях средостения возникает одышка, при внутричерепных поражениях выявляются очаговые и общемозговые симптомы. Диагноз выставляется с учетом симптомов, данных рентгенографии, УЗИ, КТ, МРТ и других методик. Лечение – операция, химиотерапия, радиотерапия.
Общие сведения
Герминогенные опухоли – группа доброкачественных и злокачественных неоплазий, возникающих из первичных половых клеток, являющихся предшественниками яичек и яичников. Из-за миграции таких клеток в период эмбриогенеза герминогенные опухоли могут развиваться за пределами гонад: в средостении, крестцово-копчиковой области, головном мозге, забрюшинном пространстве и других анатомических зонах. Первичные экстрагонадные новообразования составляют 5% от общего количества герминогенных опухолей.
Соотношение между количеством экстра- и интрагонадных неоплазий меняется с возрастом. У детей младшего возраста преобладают поражения крестцово-копчиковой зоны, по мере взросления увеличивается частота новообразований в яичках и яичниках. Герминогенные опухоли всех локализаций составляют 3% от общего количества онкологических заболеваний у детей, герминогенные новообразования яичников – 2-3% от всех злокачественных неоплазий яичников у женщин, герминогенные поражения яичка – 95% от общего числа опухолей яичка у мужчин. Лечение проводят специалисты в сфере онкологии, гинекологии, урологии и других областей медицины.

Причины герминогенных опухолей
Герминогенные опухоли возникают из зародышевых половых клеток, которые на начальных стадиях эмбриогенеза образуются в желточном мешке, а затем мигрируют по организму зародыша к урогенитальному гребешку. В процессе миграции часть таких клеток может задерживаться в различных анатомических зонах, что в последующем обуславливает образование герминогенных опухолей внегонадной локализации. В норме герминогенные клетки превращаются в зрелые клетки яичек и яичников, однако, при определенных условиях такие клетки могут оставаться в своем зародышевом состоянии и под воздействием негативных внешних и внутренних факторов давать начало новообразованиям гонад.
Установлено, что герминогенные опухоли нередко диагностируются у пациентов с различными генетическими аномалиями, например, синдромом Клайнфельтера. Выявляется наследственная предрасположенность, которая может сочетаться либо не сочетаться с хромосомными нарушениями. Характерной особенностью герминогенных опухолей является изохромосома, возникающая в результате удвоения короткого плеча и потери длинного плеча 12-й хромосомой, однако, могут обнаруживаться и другие хромосомные аномалии. Отмечается частое сочетание герминогенных опухолей с другими онкологическими поражениями, в том числе – лейкозами, лимфомами и нейробластомами. Вероятность возникновения герминогенных неоплазий яичек увеличивается при крипторхизме.
Гистологический тип герминогенных опухолей зависит от возраста. У новорожденных чаще диагностируются доброкачественные тератомы, у детей младшего возраста выявляются неоплазии желточного мешка, у подростков обнаруживаются злокачественные тератомы и дисгерминомы, у взрослых – семиномы и т. д. Факторы, способствующие активизации роста и злокачественной трансформации зародышевых половых клеток, пока не выяснены. Предполагается, что толчком к развитию герминогенных опухолей у детей могут стать хронические заболевания матери или прием матерью определенных лекарственных препаратов.
Классификация герминогенных опухолей
Существует несколько классификаций герминогенных неоплазий, составленных с учетом морфологических характеристик новообразования, расположения и особенностей течения заболевания. Согласно классификации ВОЗ, выделяют следующие морфологические типы герминогенных опухолей:
- Герминома (дисгерминома, семинома)
- Эмбриональный рак
- Неоплазия желточного мешка
- Сперматоцитная семинома
- Хорионкарцинома
- Полиэмбриома
- Тератома, в том числе – зрелая, незрелая, с определенной направленностью дифференцировки тканей (карциноид, струма яичника), злокачественная.
- Смешанная герминогенная опухоль, представляющая собой сочетание нескольких гистологических вариантов неоплазии.
Источником гермином являются первичные половые клетки, источником остальных неоплазий – элементы окружения таких клеток.
С учетом локализации различают гонадные и экстрагонадные герминогенные опухоли. Экстрагонадные неоплазии подразделяют на экстракраниальные и интракраниальные. Кроме того, выделяют злокачественные и доброкачественные герминогенные неоплазии, а также первичные и рецидивные новообразования.
Симптомы герминогенных опухолей
Особенности течения заболевания определяются локализацией, размером и степенью злокачественности неоплазии. Типичными симптомами герминогенных опухолей яичника являются боли в животе различной интенсивности в сочетании с нарушениями менструального цикла. У детей последний признак отсутствует, что обуславливает отсутствие настороженности в отношении поражения внутренних половых органов на начальных стадиях заболевания. При прогрессировании герминогенных опухолей к перечисленным симптомам присоединяются увеличение живота и нарушения мочеиспускания. При пальпации на начальных стадиях определяется округлый, умеренно подвижный узел с четкими контурами. В последующем узел увеличивается в размере, возникают увеличение и деформация живота. На поздних стадиях выявляется асцит и нарушения функций различных органов, обусловленные отдаленным метастазированием.
Герминогенные опухоли яичка проявляются увеличением соответствующей половины мошонки, чувством тяжести и распирания. Болезненность или повышенную чувствительность пораженной области отмечают около 25% пациентов. При пальпации определятся опухолевидное образование или равномерное увеличение яичка. У 5-10% больных герминогенными опухолями выявляется гидроцеле, у 10-14% — гинекомастия. При лимфогенном и отдаленном метастазировании возможны увеличение паховых лимфоузлов, неврологические расстройства, боли в костях, в спине и в животе.
Герминогенные опухоли средостения, как правило, локализуются за грудиной. Для доброкачественных новообразований (тератом) характерен медленный рост, для злокачественных (тератобластом и других неоплазий) – агрессивное распространение и быстрое прорастание близлежащих органов. Наиболее частыми проявлениями герминогенной опухоли являются одышка, кашель и боли в груди. При сдавлении верхней полой вены возникают шум в голове, головная боль, шум в ушах, расстройства сознания, сонливость и нарушения зрения. Возможны судороги. При злокачественных герминогенных опухолях наблюдаются гипертермия, лихорадка, снижение веса и нарушения функций различных органов, обусловленные прорастанием либо отдаленным метастазированием.
Забрюшинные герминогенные опухоли длительное время протекают бессимптомно. Могут проявляться диспепсией, болями в животе, дизурией, одышкой, отеками и варикозным расширением вен нижних конечностей. При злокачественных поражениях на поздних стадиях выявляются симптомы раковой интоксикации. Герминогенные опухоли крестцово-копчиковой зоны обычно диагностируются у детей раннего возраста и протекают доброкачественно. При крупных неоплазиях наблюдаются боли и слабость в нижних конечностях, нарушения дефекации и дизурия. Возможны кровотечения и некроз. Внутричерепные герминогенные опухоли чаще локализуются в зоне эпифиза, иногда – в области гипоталамуса либо гипофиза. Проявляются головной болью, тошнотой, рвотой и расстройствами движений глазных яблок.
Диагностика и лечение герминогенных опухолей
Диагноз устанавливается с учетом жалоб, результатов физикального обследования и данных дополнительных исследований. В зависимости от локализации неоплазии может потребоваться ректальный осмотр либо вагинальное исследование. Пациентам назначают УЗИ, КТ и МРТ пораженной области. Оценивают содержание альфа-фетопротеина в сыворотке крови. При злокачественных герминогенных опухолях для исключения лимфогенных и отдаленных метастазов проводят рентгенографию грудной клетки, УЗИ и МРТ органов брюшной полости, УЗИ лимфоузлов, сцинтиграфию костей скелета и другие диагностические процедуры. Тип неоплазии определяют с учетом данных гистологического исследования.
Доброкачественные герминогенные опухоли иссекают, при злокачественных новообразованиях назначают комбинированное лечение, включающее в себя операцию (при резектабельных неоплазиях), химиотерапию и радиотерапию. При наличии одиночных метастазов в легких и печени возможно их оперативное удаление. При низкой эффективности терапии агрессивных семином в некоторых случаях осуществляют высокодозную радиотерапию с последующей трансплантацией костного мозга, однако эффективность этого метода при герминогенных опухолях пока трудно оценить из-за недостаточного количества наблюдений.
Прогноз при доброкачественных неоплазиях обычно благоприятный. Злокачественные герминогенные опухоли ранее рассматривались как прогностически неблагоприятные, однако использование комбинированной терапии позволило повысить пятилетнюю выживаемость при данной патологии до 60-90%. На выживаемость влияют вид и распространенность герминогенной опухоли, радикальность хирургического вмешательства, наличие или отсутствие метастазов.
Майкл Хартманн и Тобиас Поттек
Chefartz Urologische Abteilung Bundeswehrkankenhaus Hamburg, Germany
Герминогенные опухоли яичка II стадии характеризуются наличием метастазов в забрюшинные лимфоузлы. Во всем мире насчитывается свыше 20 различных классификаций степени распространенности процесса, различающихся в небольших, но существенных деталях. В 1988 г. Illinger (1) критически отмечал, что один и тот же пациент с забрюшинным узлом размером 3 см в соответствии с различными классификациями мог быть отнесен к любой стадии от IIА до IV. В то время он рекомендовал придерживаться классификации LUGANO (2). Из-за этих несоответствий было трудно интерпретировать результаты многих публикаций, в которых использовалось «собственное» стадирование. Позднее было решено применять классификацию TNM UICC в 5-й редакции (3).
В рамках этой классификации метастазы в забрюшинные лимфоузлы оценивались с учетом клинических (N) и гистологических (pN) данных. Так, наличие забрюшинных узлов (одиночных, множественных или в виде конгломерата) размерами не более 2 см, классифицируется как «N1». Конгломераты или множественные узлы свыше 2 см, но не более 5см — как «N2». Послеоперационное стадирование относит к «pN1» наличие метастазов в 5 или менее лимфоузлах с максимальными размерами не более 2 см. К «pN2» относятся следующие случаи:
1) узлы свыше 2 см, но не более 5см;
2) свыше 5 пораженных лимфоузлов (не один из них не должен превышать 5см);
3) первичная забрюшинная внегонадная локализация опухоли.
При отсутствии других (внезабрюшинных) метастазов N1/pN1 относится к стадии IIA, а N2/pN2 — к стадии IIB. Дополнительно к этому, в классификации TNM 5-й редакции первое время также учитывался уровень a-фетопротеина (АФП), человеческого хорионического b-гонадотропина (ХГ) и лактатдегидрогеназы (ЛДГ).
На момент диагностики большинство больных несеминомными опухолями яичка относятся к I стадии. В нашем госпитале только около трети первичных пациентов имеют II стадию. Так, из 201 первичных пациентов за период с 1993 по 1998 гг. 12% относились к стадии IIA и 18% к стадии IIB (рис.1).
Зачастую небольшие забрюшинные узлы обнаруживаются только при компьютерной томографии (КТ). Большое значение здесь имеет использование перорального или внутривенного контрастирования для более четкого отграничения лимфоузлов от сосудов и кишечника. Тем не менее, при этом остается высокой частота как ложноположительных, так и ложноотрицательных результатов, достигающая 25%. Позитронно-эмиссионная КТ является более точным методом диагностики метастатических лимфоузлов. Ее эффективность в настоящее время оценивается в различных исследованиях. Однако это метод диагностики обладает высокой точностью при размерах лимфоузлов не менее 2 см (4). Определение АФП, ХГ и ЛДГ также только частично пригодно для правильного определения стадии заболевания. В классификации UICC учитывается наименьший уровень маркера после операции. Учитывая относительно длительный период полужизни АФП, снижение его до нормальных цифр при изначально высоком уровне может занять несколько недель. В связи с этим, предлагаются различные методы расчета периода полужизни маркеров, позволяющие за короткий временной интервал определить их скорость снижения (5,6).
В лечении больных II стадии несеминомных опухолей яичка возможно 2 различных подхода, дающих одинаковые шансы на излечение (7):
1. Первичная забрюшинная лимфаденэктомия (ЗЛАЭ) в сочетании или без адъювантной химиотерапии.
Во время операции полностью удаляют лимфоузлы, стараясь при этом сохранить симпатические нервы с обеих сторон (8). В последующем проводятся 2 цикла адъювантной химиотерапии (ХТ) по программе ВЕР. Без применения адъювантной ХТ возрастает частота рецидивов, однако, пациенты избегают токсичности, обусловленной ею.
2. Первичная химиотерапия в сочетании или без последующего удаления остаточной опухоли.
Проводятся 3 цикла цисплатин-содержащей ХТ, стандартом которой является ВЕР. Резидуальная опухоль размерами более 1 см после ХТ подлежит хирургическому удалению. При этом отмечается некоторое увеличение послеоперационной летальности.
Первичная ЗЛАЭ с последующей адъювантной химиотерапией.
Преимущества. Возможность точного стадирования процесса является основным преимуществом операции. Даже при использовании аппаратов КТ 4-го поколения частота ложноположительных находок колеблется от 17 до 23% (12,13,14). Большая часть этих больных не нуждается в получении дополнительной ХТ. При гистологически верифицированной I стадии частота рецидивов отмечается только в 7-12% случаев в первые 2 года с локализацией за пределами забрюшинного пространства в подавляющем большинстве случаев (15,16,17,18). При добавлении 3 курсов ХТ почти 100% этих больных излечиваются. У больных с гистологически верифицированными N1 и N2 лимфоузлами, получивших затем 2 курса адъювантной ХТ ВЕР, опасность рецидива составляет менее 3% (19,20,21). По этой причине динамическое наблюдение за ними может быть ограничено применением УЗИ и контролем маркеров.
Недостатки. Послеоперационная летальность зависит от подхода и техники операции. Baniel показал, что частота осложнений напрямую связана с опытом оперирующего хирурга. За период с 1982 по 1986 гг. у 33 (20,1%) из 164 пациентов, оперированных в госпитале Индианы, отмечались различные осложнения, тогда как за период с 1987 по 1992 гг. их число снизилось до 21 (6,6%) случая среди 314 пациентов. В большинстве случаев это были инфекционные осложнения со стороны раны и развитие послеоперационных ателектазов, что удлиняло продолжительность госпитализации, но не влияло в целом на эффект терапии у этих больных. Не было ни одного смертельного исхода, связанного с операцией (22). Потеря способности к эякуляции у больных IIA и IIB стадиями отмечается некоторыми исследователями даже при выполнении нервосохраняющих операций. Однако, хирургам еще необходимо некоторое время для освоения техники такой операции, так как результат в значительной степени зависит от их опыта.
Около 50% больных IIA и IIB стадии могут быть вылечены с помощью только одного хирургического подхода, не подвергаясь токсическому воздействию адъювантной ХТ, которое проявляется в виде возможного угнетения костномозгового кроветворения, периферической нейропатии, поражения легких и почек.
Первичная (нервосохраняющая) ЗЛАЭ без адъювантной ХТ: подход, заслуживающий внимания. Donohue в ретроспективном исследовании показал, что без применения адъювантной ХТ после ЗЛАЭ только у 26% больных В1 стадии (N n = 221
| Richie 1991 | 39 | 3 | 8% | |||
| Socinski 1988 | 12 | 1 | 8% | 2 | 2 | 100% |
| Williams 1987 | 47 | 21 | 45% | 48 | 27 | 56% |
| Pizzocaro 1984 | 11 | 4 | 36% | 15 | 5 | 33% |
| Donohue 1995 | 27 | 7 | 26% | 20 | 11 | 55% |
| Всего: | 136 | 36 | 26% | 85 | 45 | 53% |
| p 0,0000038 | ||||||
|---|---|---|---|---|---|---|
1. Illiger HJ: Therapie von Hodentumoren. Welche Stadieneinteilung sollte benutzt werden? In: Schmoll HJ, WeiЯbach L. (Hrsg.)(1988): Diagnostik und Therapie von Hodentumoren. Springer, Berlin, Heidelberg, New York, London, Paris, Tokio: 3-7
2. Cavalli F, Monfardini S, Pizzocaro G: Report on the International Workshop on Staging and Treatment of Testicular Cancer. Europ J Cancer (1980) 16: 1367-1372
3. TNM Classification of Malignant Tumours, Fifth Edition, J. Wiley & Sons, New York, 1997
4. Muller-Mattheis V; Reinhardt M; Gerharz CD; Furst G; Vosberg H; Muller-Gartner HW; Ackermann R: Positron emission tomography with [18 F]-2-fluoro-2-deoxy-D-glucose (18FDG-PET) in diagnosis of retroperitoneal lymph node metastases of testicular tumors. Urologe A (1998); 37(6):609-20
5. See WA, Cohen MB, Hoxie LD: Alpha-fetoprotein half-life as a predictor of residual testicular tumor. Cancer (1993) 71: 2048-5
6. Pottek T, Bьttner H, Hartmann M: Die Kinetik von AFP und HCG bei Hodentumoren. Berechnung und Bewertung individueller Halbwertszeiten (HWZ). Urologe [A] (1995) 34, [Suppl 1]: S 114
7. Sternberg C: Role of primary chemotherapy in stage I and low-volume stage II nonseminomatous germ-cell testis tumors. Urol Clin North Amer (1993) 20; 1: 93-109
8. Donohue JP, Foster RS, Rowland RG, Bihrle R, Jones J, Geier G: Nerve-sparing retroperitoneal lymphadenectomy with preservation of ejaculation. J Urol (1990) 144:287-292
9. Motzer RJ, Bosl GJ: Role of adjuvant chemotherapy in patients with stage II nonseminomatous germ-cell tumors. Urol Clin North Am (1993) 20: 111-116
10. Motzer RJ, Sheinfeld J, Mazumdar M,Bajorin DF, Bosl GJ, Herr H, Lyn P, Vlamis V: Etoposide and Cisplatin Adjuvant Therapy for Patients with Pathologic stage II Germ Cell Tumors. J Clin Oncol (1995) 13: 2700-2704
11. Weissbach L; Hartlapp JH: Adjuvant chemotherapy of metastatic stage II nonseminomatous testis tumor. J Urol (1991) 146: 1295-1298
12. Pizzocaro G, Nicolai N, Salvioni R, Piva L, Faustini M, Zanoni F. Comparison between clinical and pathological staging in low stage nonseminomatous germ cell testicular tumors. J Urol (1992) 148: 76-79
13. McLeod DG, Weiss RB, Stablein DM, Muggia FM, Paulson DF, Ellis JH: Staging relationships and outcome in early stage testicular cancer: a report from the testicular cancer intergroup study. J Urol (1991) 145: 1178-1183
14. Foster RS, Birhle R, Little JS, Rowland RG, Donohue JP. Stage II nonseminomatous germ cell testicular tumors: the Indiana experience and risk-benefit analysis. World J Urol (1994) 12: 143-148
15. Fossa SD, Qvist H, Stenwig AE, Lien HH, Ous S, Gierksky RE. Is postchemotherapy retroperitoneal lymph node dissection necessary in patients with malignant germ cell tumors. J Clin Oncol (1992) 10: 569-573
16. Jansen RLH, Sylvester R, Sleyfer DT, ten Bokkel WW, Kaye SB, Jones WG. Long term follow up of non-seminomatous testicular cancer patients with mature teratoma or carcinoma at postchemotherapy surgery. Eur J Cancer (1991) 27: 695-8
17. Pizzocaro G, Salvioni R, Zynoni F. Unilateral lymphadenectomy in intra-operative Stage I non-seminomatous germinal testis cancer. J Urol (1985) 134: 485-489
18. Bredael J, Vugrin D, Withmore WF. Recurrences in surgical Stage A non-seminonomatous germ cell tumors of the testis. J Urol (1983) 130: 476-8
19. Williams SD; Stablein DM; Einhorn LE; Muggia FM; Weiss RB; Donohue JP; Paulson DF; Brunner KW; Jacobs EM; Spaulding JT; DeWys WD; Crawford ED: Immediate adjuvant chemotherapy versus observation with treatment at relapse in pathological stage II testicular cancer. N Engl J Med (1987) 317; 23: 1433-8
20. Hartlapp JH; Weissbach L: Necessary extent of adjuvant chemotherapy in nonseminomatous testicular tumor stage II B. J Chemother Infect Dis Mal (1989) Suppl 1: A 10
21. Hartlapp JH; Weissbach L; Bussar-Maatz R: Adjuvant chemotherapy in nonseminomatous testicular tumor stage II. In J Androl (1987) 10: 277
22. Baniel J, Foster RS, Rowland RG, Birhle R, Donohue JP. Complications of primary retroperitoneal lymph node dissection. J Urol (1994) 152: 424-427
23. Foster RS; Donohue JP: Nerve-sparing retroperitoneal lymphadenectomy. Urol Clin North Amer (1993) 20; 1: 117-125
24. Pottek T; Hartmann M: Nervenerhaltende Operationstechniken am Beispiel der ejakulationsprotektiven nerve-sparing-RLA. In: Schreiter F (eds): Plastisch-rekonstruktive Chirurgie in der Urologie. Georg Thieme Verlag, Stuttgart New York (1999): 60-74
25. Donohue JP; Thornhill JA; Foster RS; Birhle R; Rowland RG; Einhorn LE: The role of retroperitoneal lymphadenectomy in clinical stage B testis cancer: The Indiana University experience. J Urol (1995) 153: 85-89
26. Staubitz WJ; Early KS; Magoss IV: Surgical treatment of nonseminomatous germinal testis tumors. Cancer (1973) 32: 1206-1211
27. Pizzocaro G; Monfardini S: No adjuvant chemotherapy in selected patients with pathologic stage II nonseminomatous germ cell tumors of the testis. J Urol (1984) 131: 677-680
28. Richie JP; Kantoff PW: Is adjuvant chemotherapy necessary for patients with stage B1 testicular cancer? J Clin Oncol (1991) 9: 1393-1396
29. Socinski MA; Garnick MB; Stomper PA: Stage II nonseminomatous germ cell tumors of the testis: An analysis of treatment options in patients with low-volume retroperitoneal disease. J Urol (1988) 140: 1437-1441
30. Horwich A; Norman A; Fisher C; Hendry WF; Nicholls J; Dearnaley DP: Primary cheomtherapy fьr stage II nonseminomatous germ cell tumors of the testis. J Urol (1994) 151: 72-75
31. Peckham MJ; Hendry WF: Clinical stage II nonseminomatous germ cell testicular tumours: Results of management by primary chemotherapy. Br J Urol (1985) 57: 763-768
32. Oliver RTD; Freedman LS; Parkinson MC: Medical options in the management of stages I and II testicular germ cell tumors. Urol Clin North Am (1987) 14: 721-728
33. Logothetis CJ; Swanson DA; Dexeus F: Primary chemotherapy for clinical stage II nonseminomatous germ cell tumors of the testis: A follow-up of 50 patients. J Clin Oncol (1987) 5: 906-911
34. Horwich A; Cullen HC; Stenning SP: Primary Chemotherapy after orchidectomy for stage I and II nonseminoma. Semin Oncol (1998) 25: 154-159
35. Rabbani F; Gleave ME; Coppin CM; Murray N; Sullivan LD: Teratoma in primary testis tumor reduces complete response rates in the retroperitoneum after primary chemotherapy. Cancer (1996) 78: 480-6
36. Baniel J; Foster RS; Rowland RG; Birhle R; Donohue JP: ): Complications of post-chemotherapy retroperitoneal lymph node dissection.J Urol (1995) 153: 976-980
37. Baniel J, Roth AJ, Foster RS, Donohue JP. Cost and risk benefit in the management of clinical stage II nonseminomatous testicular tumors. Cancer (1995) 75: 2897-2903
38. WeiЯbach L; Bussar-Maatz R; Flechtner H; Pichlmeier U; Hartmann M; Keller L : RPLND or primary chemotherapy in clinical stage IIA/B non-seminomatous germ cell tumours ? Results of a prospective multi-centre trial including quality of life assessment. Eur Urol (2000), in press.
Герминогенные опухоли, что это такое?
Большая часть герминогенных опухолей возникает внутри гонад. Внегонадные опухоли встречаются значительно реже, это опухоли забрюшинного пространства, переднего средостения и центральной нервной системы.
Развитие герминогенных опухолей связано с аномалиями миграции зародышевых клеток в процессе развития эмбриона.
Герминогенные опухоли встречаются в основном у молодых людей, а также у детей (более подробно об этом в статье «Герминогенные опухоли у детей»).
Большая часть этих опухолей диагностируется в пределах относительно узкого возрастного интервала: 25 — 35 лет.
Герминогенные опухоли относятся к достаточно редким заболеваниям и составляют около 1% от всех злокачественных опухолей у мужчин. Более 90% герминогенных опухолей у мужчин представлены новообразованиями яичка, т.е. могут быть отнесены к опухолям наружной локализации, доступным осмотру и пальпации.
На момент постановки диагноза большинство пациентов имеют распространенный процесс (IIC – III ст.): до 60% больных.
Классификация Всемирной Организации Здравоохранения (ВОЗ) подразделяет герминогенные опухоли на 3 категории:
- новообразования новорождённых и раннего детского возраста. К ним относят тератомы и опухоли желточного мешка. Они могут располагаться в яичках, яичниках, забрюшинном пространстве, средостении, головном мозге.
- новообразования яичка, которые возникают между 15 и 40 годами, и подразделяются на семиномы и несеминомы.
- сперматоцитные семиномы (пациенты старше 50 лет). В отличие от опухолей 1 и 2 типов, источником новообразования являются не эмбриональные зародышевые клетки, а более зрелые – сперматогонии и сперматоциты.
Вероятность возникновения герминогенных опухолей яичек увеличивается при крипторхизме (неопущении яичка в мошонку), травмах, инфекционных заболеваниях.
В группе риска находятся пациенты с различными генетическими заболеваниями.
Виды герминогенных опухолей
В зависимости от морфологической картины, клинического течения герминогенные опухоли делятся на семиномные и несеминомные опухоли. Семиномные опухоли составляют около 40%, несеминомные – 60%. Тактика лечения и прогноз различны в двух этих группах.
Семиномы характеризуются довольно вялым течением, долгое время человек не ощущает никаких симптомов болезни. Эти опухоли хорошо поддаются лечению: они чувствительны к лучевой терапии и особенно к химиотерапии.
При запущенном процессе наблюдается, как правило, лимфогенное метастазирование в забрюшинные лимфоузлы, реже в средостенные и надключичные лимфоузлы.
К данным опухолям относят следующие морфологические подтипы:
- внутрипротоковая герминогенная неоплазия неклассифицированного типа (carcinoma in situ); семинома с клетками синцитиотрофобласта;
- сперматоцитарная семинома;
- сперматоцитарная семинома с саркомой;
- эмбриональный рак;
- опухоль желточного мешка;
- трофобластические опухоли:
- хориокарцинома;
- монофазная хориокарцинома;
- трофобластическая опухоль места крепления плаценты;
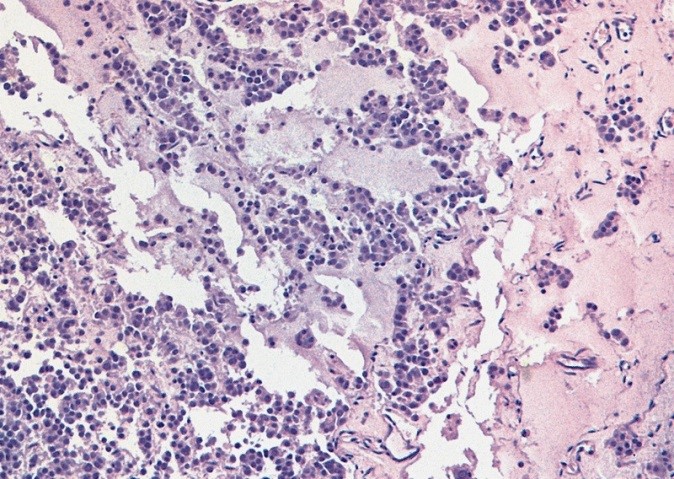
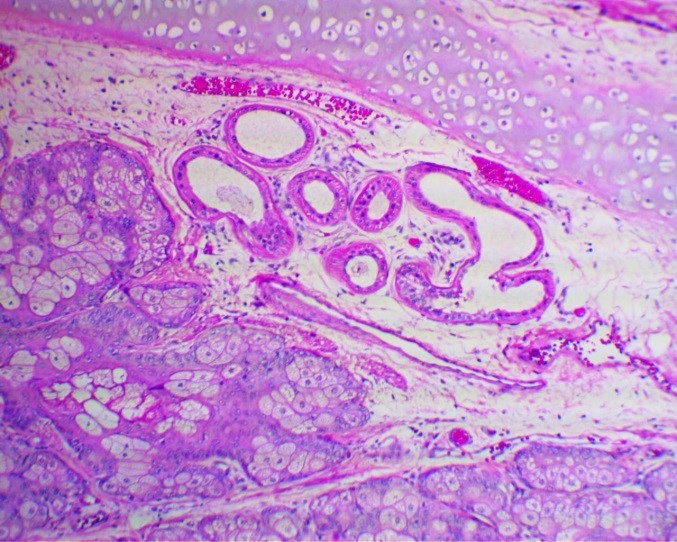
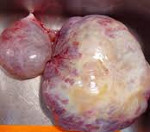
Микропрепарат, тератома яичника
Симптомы и первые признаки герминогенных опухолей
Опухоли яичка в ранних стадиях не сопровождаются болями или другими неприятными симптомами, в связи с чем долгое время не возникает стимулов для обращения к врачу.
Чаще всего пациенты приходят с жалобами на увеличение яичка, боль в мошонке, увеличение лимфоузлов. При распространенности процесса появляются симптомы интоксикации, например, слабость, снижение веса, отсутствие аппетита.
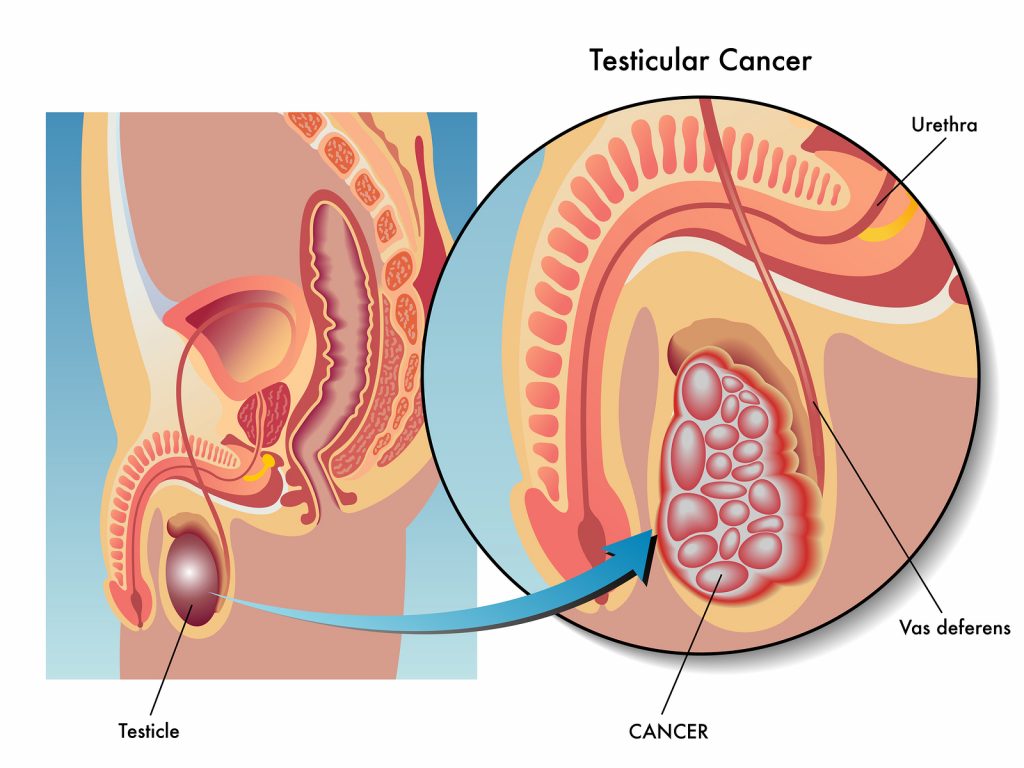
Когда опухоль располагается в средостении, особенности при ее больших размерах, пациента будут беспокоить жалобы на кашель, одышку, боли в груди, невозможность выполнять без усилия привычную физическую активность, возможна отечность шеи, синюшность кожных покровов.
Могут возникать шум в голове/ушах, ухудшение зрения, головная боль, сонливость. Это объясняется тем, что растущая опухоль давит на верхнюю полую вену.
Опухоли забрюшинного пространства обычно также не дают о себе знать длительное время. На них могут указывать такие симптомы, как нарушение стула и мочеиспускания, боли в животе, варикозное расширение вен, а также отеки.
Герминогенные опухоли центральной нервной системы (головного мозга) имеют следующие клинические проявления: головная боль, расстройство движений глазных яблок, тошнота, рвота и развитие судорог.
Диагностика герминогенных опухолей
Стандартом диагностики герминогенных опухолей является физикальный осмотр пациента, сбор анамнеза и анализ крови на биологические опухолевые маркеры. К ним относятся АФП (альфа-фетопротеин), β -ХГЧ (β единица хорионического гонадотропина человека) и ЛДГ (лактатдегидрогеназа).
В качестве уточняющих исследований проводится КТ органов брюшной полости и грудной клетки, либо УЗИ органов брюшной полости и рентгенография грудной клетки в двух проекциях.
Также выполняют МРТ головного мозга, чтобы выявить наличие метастазов в нем.
Орхофуникулэктомия — удаление яичка, выполняется с диагностической и лечебной целью.
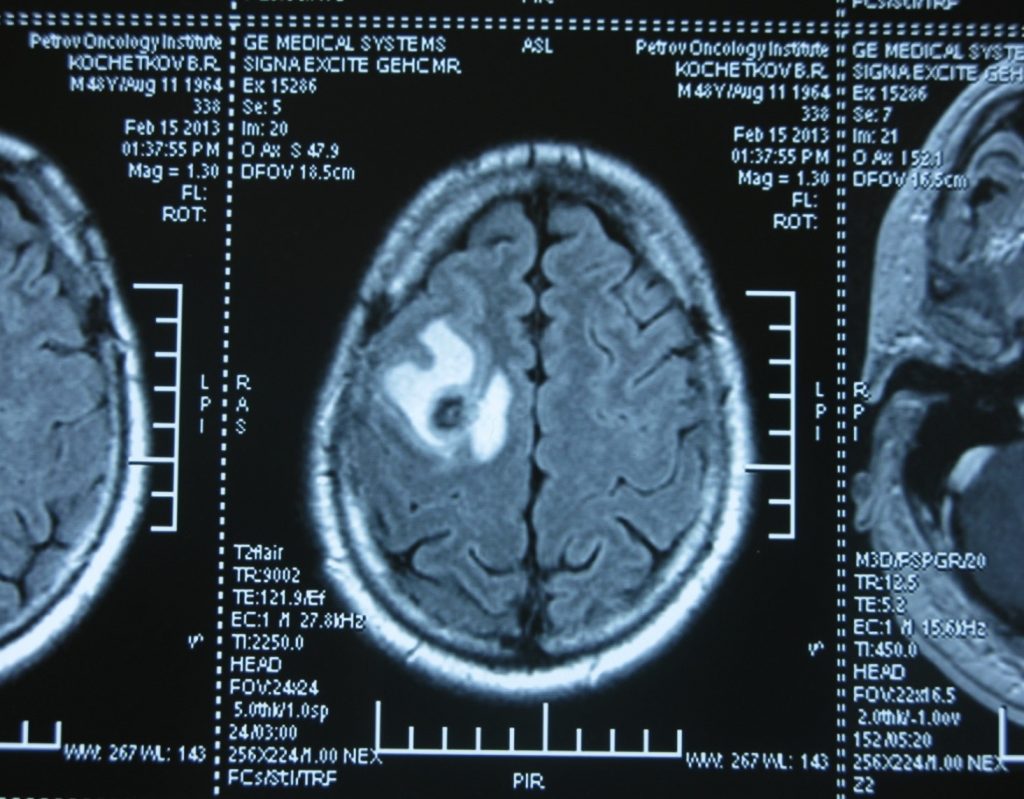
Метастаз в головной мозг при герминогенных опухолях (МРТ головного мозга)
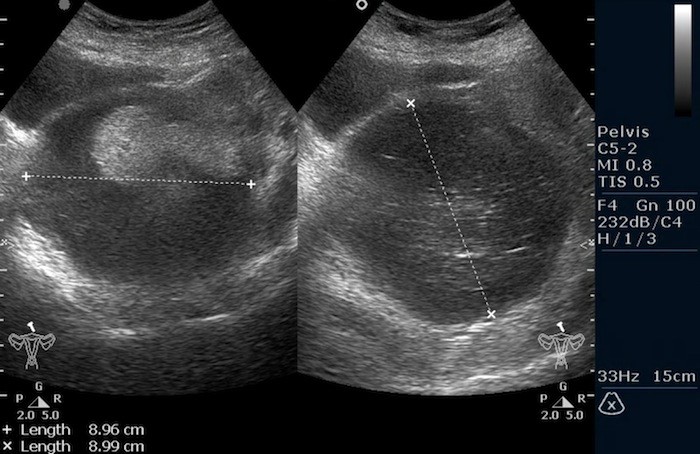
Тератома яичника (УЗИ малого таза)
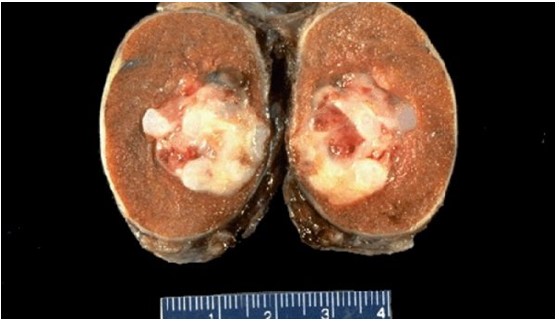
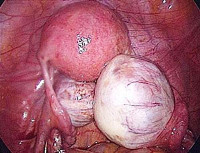
Герминогенная опухоль яичка (макропрепарат)
Стадии герминогенных опухолей
Для выработки индивидуального плана лечения учитываются классификации TNM, а также классификация метастатических герминогенных опухолей Международной объединенной группы по герминогенным опухолям (IGCCCG).
Стадирование герминогенных опухолей в соответствии с классификацией ТNМ
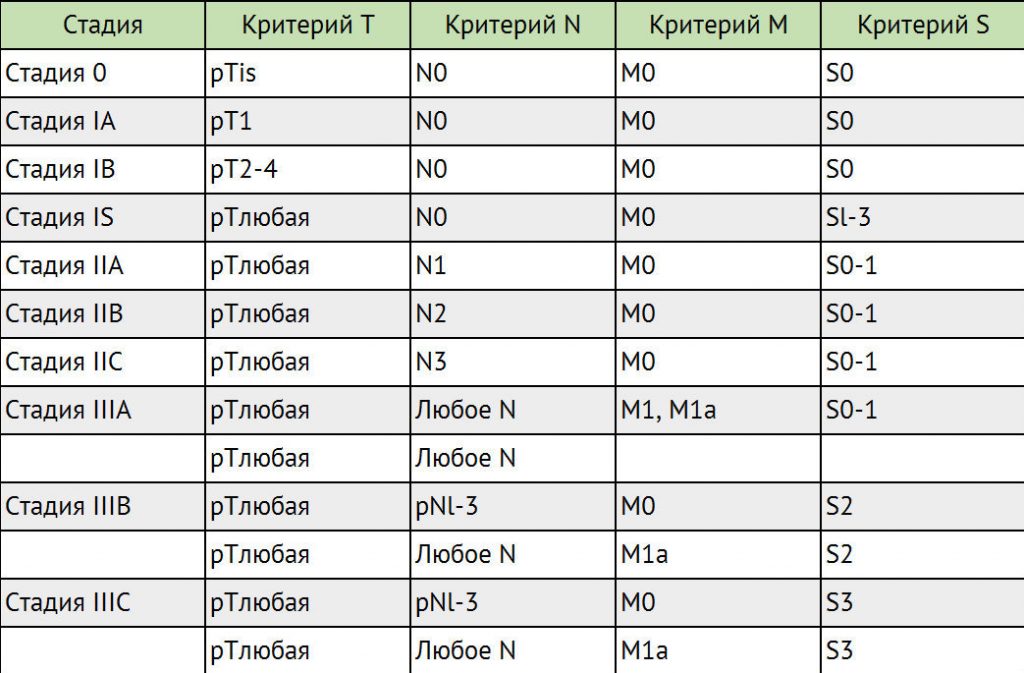
Для герминогенных опухолей IV стадия заболевания не предусмотрена.
Классификация IGCCCG включает в себя ряд таких прогностических факторов как гистологическая форма, локализация первичной опухоли и расположение метастазов. Учитываются уровни опухолевых маркеров: АФП (альфа-фетопротеина), ХГ (хорионического гонадотропина) и ЛДГ (лактатдегидрогеназы). На их основе определяется прогноз пациента – «хороший», «промежуточный» или «неблагоприятный»
Методы лечения герминогенных опухолей
К настоящему времени в онкологической практике накоплен большой научно-практический материал, разработаны стандарты и международные рекомендации по лечебной тактике больных герминогенными опухолями.
При герминогенных опухолях проводится, как правило, комплексное лечение, которое включает в себя хирургическое лечение, системное противоопухолевое лечение, реже лучевую терапию.
Метод лечения основывается на морфологическом типе опухоли, группе прогноза и стадии заболевания.
Большинство больных герминогеными опухолями добиваются излечения даже при распространенной форме заболевания, когда процесс не ограничен только первичной опухолью. Наиболее эффективная схема лечения – это химиотерапия с последующим удалением остаточных опухолевых очагов.
Хирургические методы:
- орхфуникулэктомия
- забрюшинная лимфаденэктомия,
- удаление легочных метастазов и пр.
Лучевая терапия назначается чаще при поражении головного мозга. Ее применение обусловлено возможностью точного локального воздействия на опухолевые массы.
Химиотерапия
Показания к химиотерапии определяются степенью распространенности процесса, наличием легочных/внелегочных метастазов. Стандартным режимом химиотерапии при герминогенных опухолях является режим «BEP», включающий блеомицин, этопозид и цисплатин. Для пациентов с дыхательной недостаточностью, обширным поражением легких, во избежание легочной блеомициновой токсичности, как альтернативный вариант, может быть использованы режимы химиотерапии VIP (этопозид, ифосфамид, цисплатин) или ЕР (этопозид, цисплатин).
Следует отметить, что при проведении системного лекарственного лечения необходимо строгое соблюдение временных рамок (начало очередного цикла проводится на 22 день).
Для оценки эффективности химиотерапии каждые 2 цикла и после ее окончания проводится компьютерная томография исходных зон поражения, перед каждым циклом мониторинг уровня опухолевых маркеров. Рост маркеров на фоне лечения или после его завершения, а также замедление их снижения свидетельствует об активности опухолевого процесса и необходимости проведения второй линии химиотерапии.
Перед проведением химиотерапии рекомендуется обдумать и решить вопрос о необходимости криоконсервации спермы.
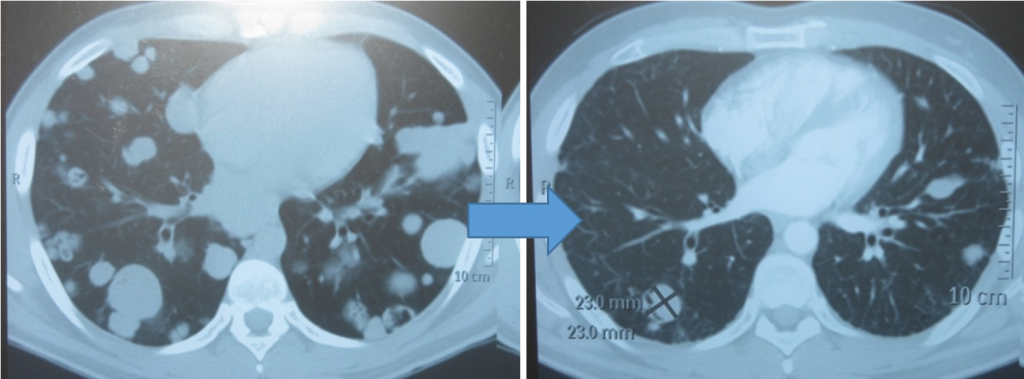
Метастазы в легких до лечения и после 4х циклов химиотерапии по схеме «ВЕР» (КТ грудной клетки)
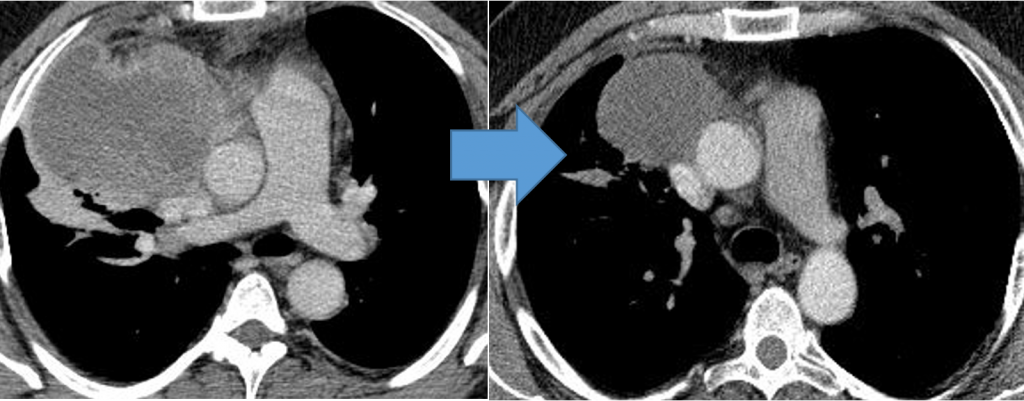
Герминогенная опухоль средостения до лечения и после 4х циклов химиотерапии по схеме «ВЕР » — уменьшение опухоли более чем на 50% (КТ грудной клетки)
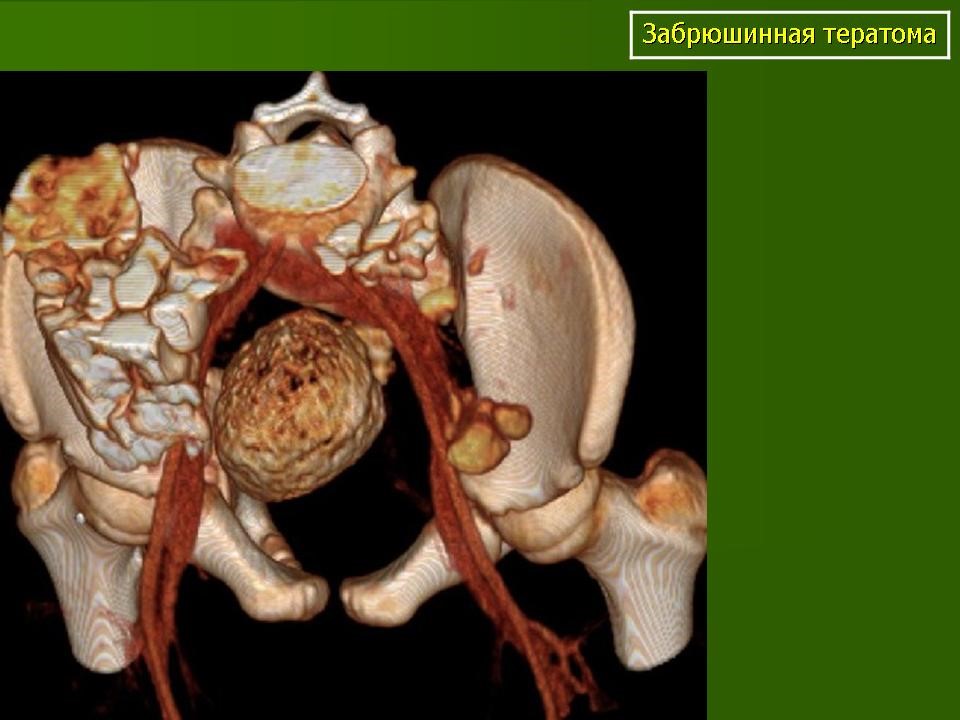
Забрюшинная тератома (3D реконструкция)
Контроль эффективности лечения и динамическое наблюдение.
Перед началом каждого цикла химиотерапии проводится контроль онкомаркеров (АФП, ЛДГ, ХГЧ).
Обязательный принцип динамического наблюдения за больными герминогенными опухолями — строгое соблюдение временных промежутков при выполнении контрольного обследования. Первый год после лечения необходимо проходить обследование каждые два месяца, а на второй год – раз в три месяца.
Следующие два года нужно обследоваться сначала каждые четыре месяца, затем каждые шесть месяцев. И далее планируется ежегодный поход к врачу.
Перечень обследований рекомендованных к выполнению в период динамического наблюдения: физикальный осмотр, кровь на маркеры (АФП, ЛДГ, ХГЧ), УЗИ пахово-подвздошных областей, брюшной полости и забрюшинного пространства, рентгенография органов грудной клетки каждые 6 месяцев.
Прогноз выживаемости
Благодаря успехам в развитии химиотерапии, герминогенные опухоли стали ярким примером курабельных солидных опухолей. Пятилетняя выживаемость больных герминогенными опухолями составляет от 60 до 90%.
Классификация метастатических герминогенных опухолей Международной объединенной группы по герминогенным опухолям (IGCCCG), основанная на прогностических факторах
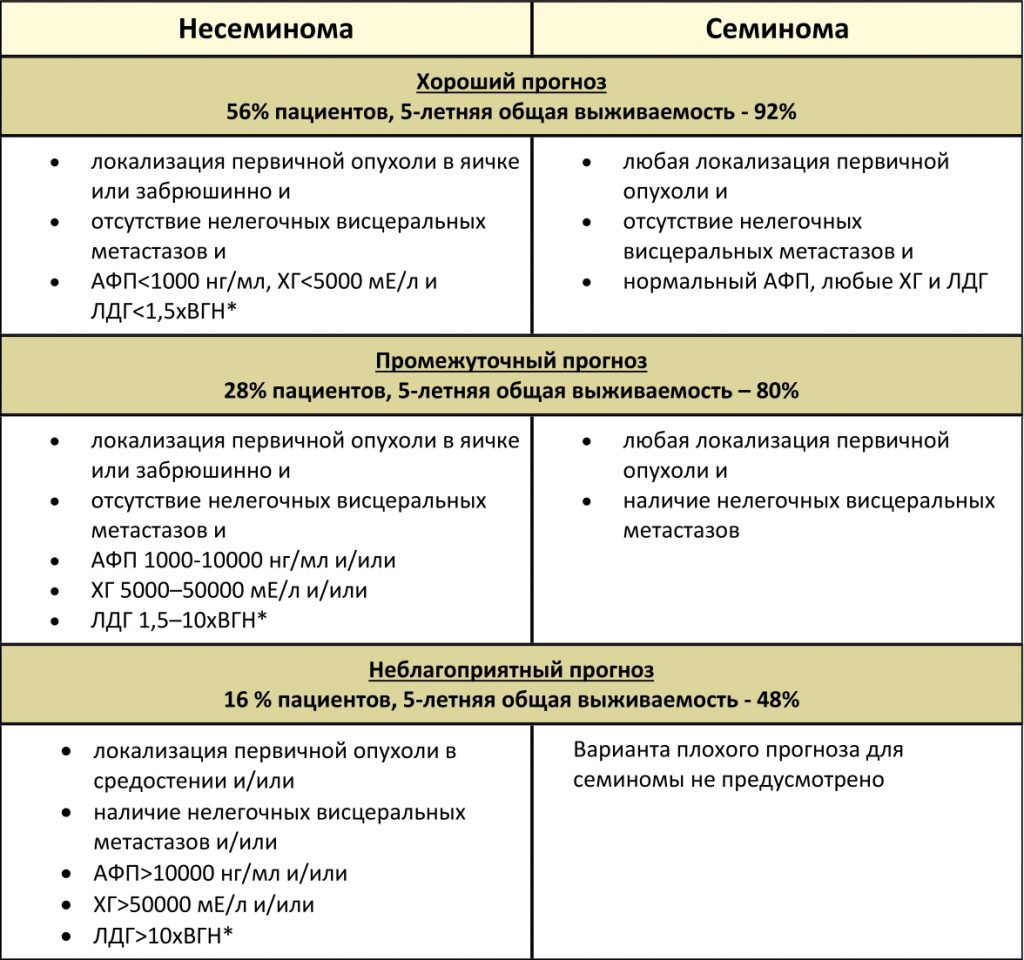
*ВГН – верхняя граница нормы.

Авторская публикация:
СЕМЕНОВА АННА ИГОРЕВНА ,
химиотерапевт, онколог ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, кандидат медицинских наук
«>
