Иммуноферментный метод elisa
Содержание:
Иммуноферментный анализ: виды и основные отличия
Наиболее часто на практике используются три варианта твердофазного иммуноанализа — непрямой иммуноанализ, прямой иммуноанализ и иммуноанализ сэндвич-типа. Различия между этими типами иммуноанализа заключаются в следующем. В непрямом варианте иммуноанализа на первой стадии на поверхность лунок полистирольного планшета сорбируется антиген. После удаления несвязавшихся молекул антигена добавляется образец, содержащий специфичные к данному антигену антитела. Образовавшиеся комплексы антиген-антитело детектируются с помощью анти-видовых антител, конъюгированных с какой-либо меткой (Рис. 1А). В прямом варианте иммунанализа детекция сорбированного антигена осуществляется непосредственно с помощью специфичных антител, конъюгированных с меткой (Рис. 1Б). В иммуноанализе сэндвич-типа на первой стадии на поверхность планшета сорбируется не антиген, а антитела, специфичные к исследуемому антигену (антитела подложки). После удаления не связавшихся молекул антител добавляется образец, содержащий антиген. Для детекции образовавшегося комплекса антитела подложки-антиген добавляются вторые антитела, специфичные к другому, пространственно удаленному, эпитопу антигена, конъюгированные с какой-либо меткой (Рис. 1В). Использование в иммуноанализе сэндвич-типа антител, специфичных к двум различным эпитопам антигена, позволяет добиться высокой чувствительности и специфичности при определении антигена даже в таких гетерогенных образцах, как плазма крови.
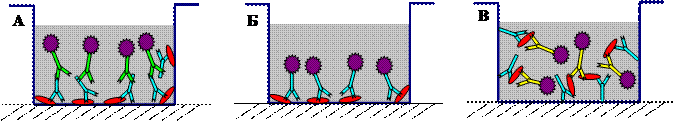
Рис. 1. Принцип непрямого (А), прямого (Б) и иммуноанализа сэндвич-типа (В)
Непрямой иммуноферментный анализ (indirect ELISA)
Метод непрямого иммуноанализа характеризуется осуществлением 3-х стадийного процесса, на первой стадии которого антиген адсорбируется на специально подготовленном пластике, на второй с антигеном взаимодействуют специфичные к нему антитела, а на третьей в систему вводят антивидовые антитела, конъюгированные с ферментом, обуславливающим проведение индикаторной ферментативной реакции. В данной методике в качестве фермента используют пероксидазу хрена. Реакция проводится в специальных 96-луночных планшетах.
I. Сорбция антигена
В лунки 96-луночного планшета для проведения иммуноанализа сорбируют антиген 0,1-0,5 мкг в лунку в 100 мкл фосфатно-солевого буфера (PBS). Инкубация проводится в течение 30 минут при комнатной температуре и встряхивании на горизонтальном шейкере для планшетов. Отмывка (2-х кратная) несвязавшихся молекул антигена осуществляется фосфатно-солевым буфером содержащим 0.1% Tween-20 (PBSТ).
II. Блокировка
Для блокирования мест неспецифического связывания лунки планшета заполняют PBST и инкубируют в течение 10-15 минут при комнатной температуре.
III. Раститровка специфичных антител
Раститровку можно проводить как по горизонтальным, так и по вертикальным рядам планшета. Необходимо отметить, что раститровка антител проводится в том случае, если необходимо подобрать оптимальную концентрацию антител или определить титр. В том случае, если оптимальная концентрация и/или титр антител определены, то используют рекомендованное для данных конкретных антител разведение.
При раститровке в первую лунку ряда вносят готовое разведение антител — в среднем 1-10 мкг в лунку, далее проводят последовательное разведение антител в лунках. Инкубацию со специфичными антителами проводят в течение 30 минут при комнатной температуре и встряхивании на горизонтальном шейкере для планшетов. Отмывка осуществляется с помощью PBSТ 3 раза.
IV. Добавление антивидовых антител, конъюгированных с ферментной меткой
В качестве детекторных (вторичных) антител используются антивидовые поликлональные антитела, конъюгированные с пероксидазой хрена. Чаще всего используются козьи или кроличьи антитела, специфичные к целой молекуле или к Fc-фрагментам специфичных антител. Концентрация детекторных антител как правило указывается производителем в виде разведения исходного раствора (например, 1:1000). Инкубация со вторичными антителами проводится в течение 30 минут при комнатной температуре и встряхивании на горизонтальном шейкере для планшетов. Отмывка осуществляется с помощью PBSТ 5-6 раз.
Пероксидаза хрена катализирует реакцию окисления субстрата перекисью водорода. В качестве субстрата пероксидазы хрена используется о-фенилендиамин (ОФД). В результате прохождения реакции образуется окрашенный продукт окисления ОФД.
Раствор субстрата: К 10 мл субстратного буфера (0,1 М Na-цитратный буфер, рН 4,5) добавить 0,01 мл 30% перекиси водорода и 0,2 мл 50х раствора ОФД (340 мг ОФД в 10 мл этилового спирта; хранить при –20°С).
Инкубация проводится в течение 10 минут при комнатной температуре и встряхивании на горизонтальном шейкере для планшетов.
V. Остановка ферментативной реакции
Перед измерением оптической плотности проводят остановку цветной реакции с помощью 0,5 М H2SO4. В лунки с рабочим раствором ОФД после инкубации вносят по 50 мкл раствора 0,5 М серной кислоты. После этого можно сразу приступать к измерению оптической плотности.
VI. Измерение оптической плотности
Оптическая плотность раствора окрашенного продукта измеряется при λ=490 нм с использованием планшетного спектрофотометра.
Прямой иммуноферментный анализ (direct ELISA)
Методика прямого иммуноанализа имеет лишь небольшие отличия по сравнению с методикой непрямого иммуноанализа. Так, стадии I и II одинаковы в обоих типах анализа. Отличие заключается в том, что в прямом варианте иммуноанализа на стадии III используют специфичные антитела, конъюгированные с ферментной меткой. При необходимости также можно проводить раститровку специфичных антител, конъюгированных с ферментной меткой, аналогично описанному ранее для неконъюгированных антител. Стадия IV опускается, а дальнейшие стадии (V-VII) проводятся аналогично описанному выше для непрямого варианта иммуноанализа.
Иммуноанализ сэндвич-типа (Sandwich-type immunoassay)
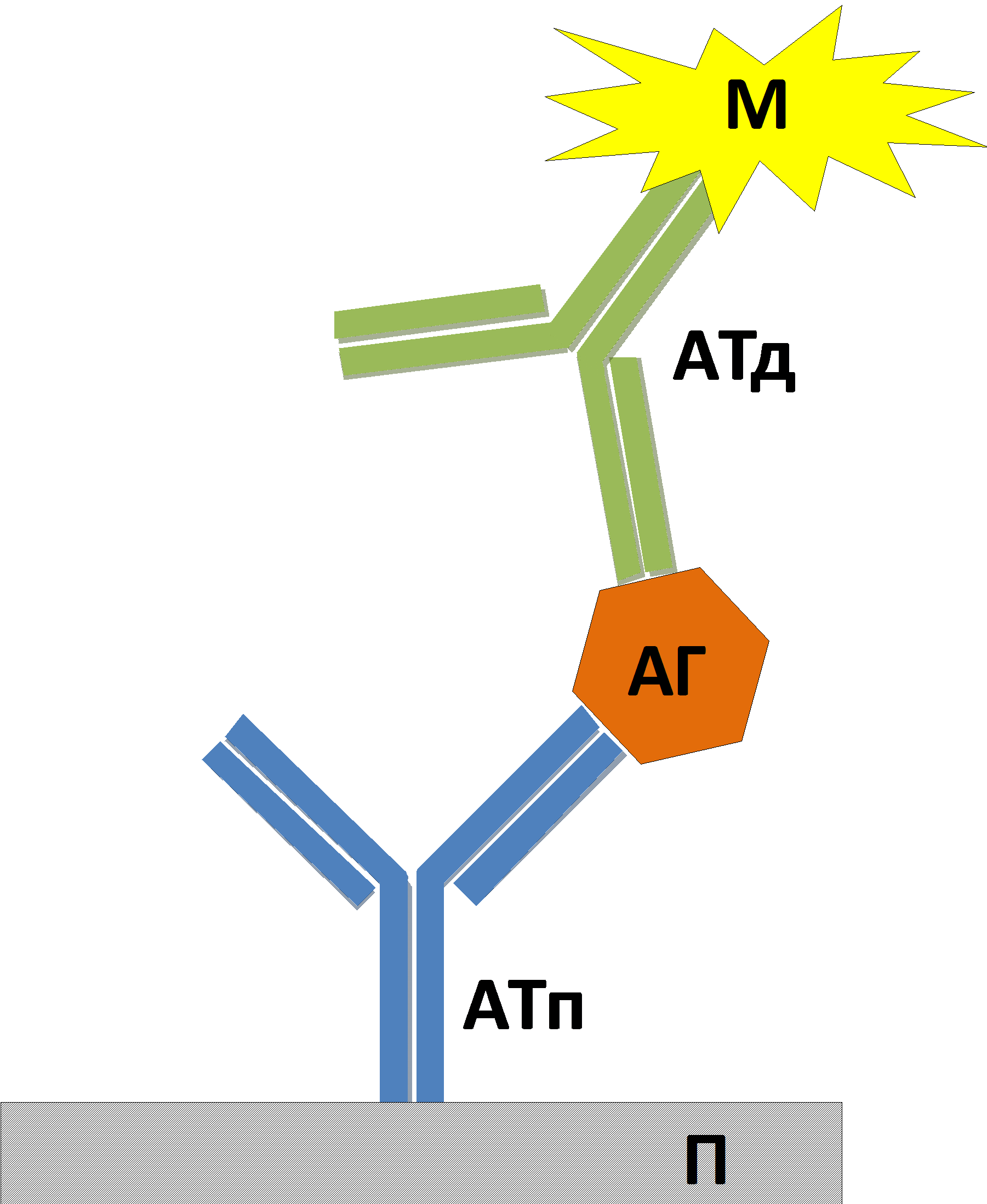
Рис. 2. Схематическое изображение иммуноанализа «сэндвич»-типа. АТп — антитело подложки, АТд — детекторное антитело, АГ — антиген, М — метка, ковалентно связанная с детекторным антителом, П — подложка, на которую сорбируется антитело подложки.
В данном варианте иммуноанализа (Рис.2) используется пара антител, специфичных к пространственно удаленным эпитопам исследуемого антигена.
I. Сорбция антител подложки
В лунки 96-луночного планшета для проведения иммуноанализа сорбируют антитела подложки 1-2 мкг в лунку в 100 мкл фосфатно-солевого буфера (PBS). Инкубация проводится в течение 30 минут при комнатной температуре и встряхивании на горизонтальном шейкере для планшетов. Отмывка (2-х кратная) несвязавшихся молекул антигена осуществляется фосфатно-солевым буфером содержащим 0,1% Tween-20 (PBSТ).
II. Блокировка
Для блокирования мест неспецифичного связывания лунки планшета заполняют PBST и инкубируют в течение 10-15 минут при комнатной температуре.
III. Инкубация с антигеном
В лунки планшета с преадсорбироваными антителами вносят по 50 мкл исследуемого раствора либо стандартных разведений антигена. Разведения антигена должны быть приготовлены на основе PBST, поскольку Tween-20 снижает неспецифичное связывание белковых молекул друг с другом и с поверхностью планшета. И исследуемый раствор, и стандартные разведения антигена вносят попарно (либо по 3 повторности), используя по две (три) лунки на каждое разведение белка. Инкубацию проводят при комнатной температуре в течение 30 мин при постоянном перемешивании. Отмывка осуществляется раствором PBST 3 раза.
IV. Инкубация с антителами, конъюгированными с ферментной меткой
В лунки планшета вносят по 100 мкл раствора специфичных антител, конъюгированных с ферментной меткой. Оптимальная концентрация конъюгированных антител как правило указывается производителем (обычно используют концентрацию 2-4 мкг/мл). Инкубация с антителами, содержащими ферментную метку, проводится в течение 30 минут при комнатной температуре и встряхивании на горизонтальном шейкере для планшетов. Отмывка осуществляется с помощью PBSТ 5-6 раз.
V. Проведение ферментативной реакции, сопровождающейся появлением окрашенного продукта
В лунки вносят по 100 мкл раствора субстрата и инкубируют в течение 10 мин при комнатной температуре и постоянном перемешивании.
VI. Остановка ферментативной реакции
Перед измерением оптической плотности проводят остановку цветной реакции с помощью 0,5 М H2SO4. В лунки с рабочим раствором ОФД после инкубации вносят по 50 мкл раствора 0,5 М серной кислоты. После этого можно сразу приступать к измерению оптической плотности.
VII. Измерение оптической плотности
Оптическая плотность раствора окрашенного продукта измеряется при λ=490 нм с использованием планшетного спектрофотометра.
В связи с развитием клеточных технологий, молекулярной биологии, генетики, физики, химии и ряда других высокотехнологичных дисциплин в повседневную практику внедряются новые высокоточные и высокотехнологичные методы. Данные междисциплинарные тенденции затрагивают и область медицинских знаний, и смежные области биологических, биохимических проблем. За последние десять лет получил широкое распространение и внедрение в массовую практику метод клинической лабораторной диагностики под названием иммуноферментный анализ.
Вообще технологии иммунологических ферментативных и радиологических реакций широко использовались в типировании клеток, культур клеток, различных тканей с начала 80-х годов XX столетия. Однако методы эти были очень трудоемкими, не унифицированными, не стандартизированными, что исключало их использование в лечебно-диагностических целях в массовом порядке. Такими методами пользовались лишь узкие, наукоемкие и высокоспециализированные лаборатории.
Однако с развитием техники, микротехники, производства различных биополимерных материалов стало возможным производить готовые наборы иммуноферментной диагностики, которыми смогут пользоваться лаборатории лечебно-профилактических учреждений широкого профиля. ИФА широко используется для диагностики всевозможных инфекций (хламидиоз, сифилис, цитомегаловирус, токсоплазмоз, герпес и т.д.), как острых, так и хронических, а также скрытых форм, которые протекают без клинических симптомов.Также этот метод применяют для контроля над хроническими заболеваниями. Давайте постараемся разобраться, что это за метод, и какие принципы лежат в его основе?
Компоненты иммуноферментного анализа – иммунная реакция и ферментативная реакция
Иммунная реакция, что это? Что такое антитело, антиген?
 Что такое иммунная реакция? Что такое антиген?
Что такое иммунная реакция? Что такое антиген?
В первую очередь разберем, что такое иммунные реакции. Иммунные реакции – это специфические реакции связывания антигена с антителом с образованием иммунного комплекса. Что это значит? На поверхности каждой клетки любого организма имеются особые структуры, которые называются антигены. Антигены в целом – это молекулы, которые несут информацию о клетке (подобно информации на бейдже у человека, где указываются основные данные этого человека).
Индивидуальные и видовые антигены – что это? Зачем нужны эти антигены?
Имеются антигены индивидуальные, то есть присущие только данному конкретному организму. Эти индивидуальные антигены разные у всех людей, есть похожие друг на друга, но все равно отличающиеся. Двух одинаковых копий индивидуальных антигенов в природе не существует!
Второй основной тип антигенов – это видовые антигены, то есть присущие какому-либо конкретному виду живых существ. Например, у человека присутствует свой видовой антиген, общий для всех людей, у мышей имеется свой мышиный видовой антиген и т.д. На поверхности каждой клетки обязательно присутствуют видовой и индивидуальный антиген.
 Видовой антиген используют клетки иммунной системы для опознавания «свой – чужой».
Видовой антиген используют клетки иммунной системы для опознавания «свой – чужой».
Как происходит узнавание антигена?
Иммунная клетка связывается с подозрительной клеткой и проводит опознание именно по индивидуальному антигену. В памяти иммунной клетки «записано» как выглядит «свой антиген». Таким образом, если антиген подозрительной клетки совпадает с описанием «свой антиген», значит, эта клетка собственного организма и опасности не представляет. Тогда иммунная клетка «отвязывается» и уходит. А если антиген не совпадает с описанием «свой», тогда иммунная клетка идентифицирует эту клетку как «чужой», а значит потенциально опасный для всего организма. В этом случае иммунная клетка не «отвязывается», а начинает уничтожать опасный объект. Точность такого иммунологического узнавания поражает воображение – 99,97%. Ошибок практически не бывает!
Что такое антитело, иммунный комплекс? 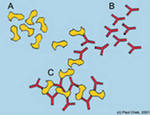 А что представляет собой антитело?
А что представляет собой антитело?
Антитело – это особая молекула, расположенная на поверхности иммунной клетки. Именно антитело и связывается с антигенами подозрительной клетки. Далее антитело передает информацию внутрь клетки, где происходит опознавание, и получает обратный сигнал двух видов «свой» или «чужой». При сигнале «свой» антитело разрушает связь с антигеном и отпускает клетку.
Что такое иммунный комплекс?
При сигнале «чужой» ситуация разворачивается иначе. Антитело не разрывает связь с антигеном, а наоборот, посылая специфические сигналы, вызывает «подкрепление». Биологически это означает, что другие антитела, находящиеся в другой части клетки, начинают перемещаться к участку, откуда идет сигнал опасности, и также образуют связь между собой и пойманным антигеном. В конце концов, антиген оказывается, окружен со всех сторон и прочно привязан.Такой комплекс антиген + антитело называется иммунный комплекс. С этого момента начинается утилизация антигена. Но сейчас подробности процесса нейтрализации антигена нас не интересуют.
Виды антител (IgA, IgM, IgG, IgD, IgE)  Антитела – это белковые структуры, которые, соответственно, имеют химическое название, которое и используется как синоним слова антитела. Итак, антитела = иммуноглобулины.
Антитела – это белковые структуры, которые, соответственно, имеют химическое название, которое и используется как синоним слова антитела. Итак, антитела = иммуноглобулины.
Существуют 5 типов иммуноглобулинов (Ig), которые связываются с разными видами антигенов в разных местах человеческого организма (например, на коже, на слизистых, в крови и т. д.). То есть антитела имеют разделение труда. Эти иммуноглобулины называются буквами латинского алфавита – A, M, G, D, E и обозначаются следующим образом – IgA, IgM, IgG, IgD, IgE.
В диагностике используют только один вид антител, который наиболее специфичен в отношении определяемого микроба. То есть связывание данного вида антител с определяемым антигеном происходит всегда. Чаще всего применяются IgG и IgM.
Именно этот принцип иммунной реакции (уникальная точность и специфичность узнавания определяемого биологического объекта) лежит в основе иммуноферментного анализа.В силу высокой точности антител в узнавании антигенов, точность всего метода иммуноферментного анализа оказывается также высочайшей.
Ферментативная реакция
Какая реакция – ферментативная? Что такое сродство, субстрат и продукт реакции?  Перейдем к рассмотрению ферментативной реакции в работе метода иммуноферментного анализа.
Перейдем к рассмотрению ферментативной реакции в работе метода иммуноферментного анализа.
Что такое ферментативная реакция?
Ферментативная реакция – это химическая реакция, при которой одно вещество под действием фермента превращается в другое. Вещество, на которое действует фермент,называется субстратом. А вещество, которое получается в результате воздействия фермента, называется продуктом реакции. Причем особенность ферментативной реакции такова, что определенный фермент действует только на определенный субстрат. Такое свойство фермента узнавать «свой» субстрат называется сродством.
Таким образом, каждый фермент проводит только одну, специфичную для него реакцию. Ферментов в биологическом мире известно великое множество, равно как и ферментативных реакций. В иммуноферментной диагностике используется лишь несколько ферментативных реакций – не более 10.При этом выбирали такие ферментативные реакции, продуктом которых являются окрашенные вещества. Почему же продукты ферментативной реакции должны быть окрашенными? Потому что для вычисления концентрации вещества по окрашенному раствору существует простой химический метод – колориметрия.
Метод колориметрии – суть и принцип
 Колориметрия применяет измерение плотности окраски раствора, а по плотности окраски вычисляют концентрацию вещества.При этом специальный прибор – колориметр измеряет плотность окраски раствора. В колориметрии возможны два варианта зависимости плотности окраски от концентрации вещества – это прямо пропорциональная зависимость или обратно пропорциональная зависимость. При прямо пропорциональной зависимости, чем выше концентрация вещества, тем интенсивнее плотность окраски раствора. При обратно пропорциональной зависимости, чем выше концентрация вещества, тем ниже плотность окраски раствора. Технически это происходит так: берется несколько растворов с известной концентрацией вещества, измеряется плотность этих растворов, строится график зависимости концентрации от плотности окраски (калибровочный график).
Колориметрия применяет измерение плотности окраски раствора, а по плотности окраски вычисляют концентрацию вещества.При этом специальный прибор – колориметр измеряет плотность окраски раствора. В колориметрии возможны два варианта зависимости плотности окраски от концентрации вещества – это прямо пропорциональная зависимость или обратно пропорциональная зависимость. При прямо пропорциональной зависимости, чем выше концентрация вещества, тем интенсивнее плотность окраски раствора. При обратно пропорциональной зависимости, чем выше концентрация вещества, тем ниже плотность окраски раствора. Технически это происходит так: берется несколько растворов с известной концентрацией вещества, измеряется плотность этих растворов, строится график зависимости концентрации от плотности окраски (калибровочный график).
Далее измеряют плотность окраски раствора, концентрацию которого выясняют, и по калибровочному графику находят значение концентрации, соответствующее уровню измеренной плотности окраски раствора.В современных автоматических колориметрах только один раз проводят калибровку, далее аппарат сам строит калибровочную кривую, которая остается в памяти прибора, и измерение происходит автоматически.
В иммуноферментном анализе чаще всего применяются следующие ферменты: пероксидаза, щелочная фосфатаза, авидин.
Как же совмещаются иммунологическая и ферментативная реакция в иммуноферментном анализе? Сейчас мы перейдем к рассмотрению собственно иммуноферментного анализа. Какие этапы он включает и что происходит при протекании этих реакций? Иммуноферментный анализ бывает прямой и непрямой.
Прямой иммуноферментный анализ – этапы проведения
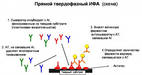
В прямом иммуноферментном анализе используют антитела к выявляемому антигену, соединенные со специфической меткой. Эта специфическая метка и есть субстрат ферментативной реакции.
 Прикрепление антигенов к поверхности лунки и соединение антигена с антителом
Прикрепление антигенов к поверхности лунки и соединение антигена с антителом
Как проходит прямой иммуноферментный анализ? Берется биологический материал (кровь, соскобы со слизистых, мазки) и помещается в специальные лунки. Биологический материал оставляют в лунках на 15-30 минут, чтобы антигены могли приклеиться к поверхности лунок. Далее в эти лунки добавляют антитела к выявляемому антигену. Это значит, что выявляя антигены, например, сифилиса, добавляются антитела против антигенов сифилиса. Эти антитела получают промышленным способом, а лаборатории покупают уже готовые наборы.Данную смесь исследуемого материала и антител оставляют на некоторое время (от 30 минут до 4-5 часов), чтобы антитела смогли найти и связаться со «своим» антигеном.Чем больше в биологической пробе антигенов, тем больше антител свяжется с ними.
Удаление «лишних» антител
Как было указано, антитела к тому же связаны со специфической меткой.Поскольку антитела добавляются в избытке, то не все они свяжутся с антигенами, а если антигена вообще нет в пробе, то, соответственно, ни одно антитело не свяжется с искомым антигеном. Для того чтобы убрать «лишние» антитела, содержимое из лунок просто выливают. В результате этого все «лишние» антитела убираются, а остаются те, которые связались с антигенами, поскольку антигены «приклеены» к поверхности лунок. Лунки несколько раз ополаскивают специальным раствором, который позволяет вымыть все «лишние» антитела.
Ферментативная реакция – образование окрашенного соединения
 Далее начинается второй этап – ферментативная реакция. В промытые лунки добавляют раствор с ферментом и оставляют на 30-60 минут. Данный фермент имеет сродство к веществу (специфической метке), с которым связаны антитела. Фермент проводит реакцию, в результате которой эта специфическая метка (субстрат) превращается в окрашенное вещество (продукт). Затем методом колориметрии находят концентрацию этого окрашенного вещества. Поскольку данная специфическая метка связана с антителами, значит, концентрация окрашенного продукта реакции равна концентрации антител. А концентрация антител равна концентрации антигенов. Таким образом, в результате проведенного анализа мы получаем ответ, какова концентрация выявляемого микроба или гормона.
Далее начинается второй этап – ферментативная реакция. В промытые лунки добавляют раствор с ферментом и оставляют на 30-60 минут. Данный фермент имеет сродство к веществу (специфической метке), с которым связаны антитела. Фермент проводит реакцию, в результате которой эта специфическая метка (субстрат) превращается в окрашенное вещество (продукт). Затем методом колориметрии находят концентрацию этого окрашенного вещества. Поскольку данная специфическая метка связана с антителами, значит, концентрация окрашенного продукта реакции равна концентрации антител. А концентрация антител равна концентрации антигенов. Таким образом, в результате проведенного анализа мы получаем ответ, какова концентрация выявляемого микроба или гормона.
Именно так проходит прямой иммуноферментный анализ. Однако сегодня чаще используют непрямой иммуноферментный анализ, поскольку чувствительность и точность непрямого выше, чем прямого. Итак, перейдем к непрямому иммуноферментному анализу.
Непрямой иммуноферментный анализ – этапы проведения
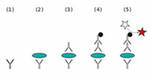 В непрямом иммуноферментном анализе два этапа. При проведении первого этапа используют немеченые антитела к выявляемым антигенам, а во втором этапе применяют меченые антитела к первым немеченым антителам. То есть получается не прямое связывание антитела с антигеном, а двойной контроль: связывание антител с антигеном, после чего связывание вторых антител с комплексом антитело + антиген. Как правило, антитела для первого этапа – мышиные, а для второго – козьи.
В непрямом иммуноферментном анализе два этапа. При проведении первого этапа используют немеченые антитела к выявляемым антигенам, а во втором этапе применяют меченые антитела к первым немеченым антителам. То есть получается не прямое связывание антитела с антигеном, а двойной контроль: связывание антител с антигеном, после чего связывание вторых антител с комплексом антитело + антиген. Как правило, антитела для первого этапа – мышиные, а для второго – козьи.
Фиксация антигенов на поверхности лунки и связывание антигена с немеченым антителом
Так же как и для прямого иммуноферментного анализа производится забор биологического материала – кровь, соскобы, мазки. Исследуемый биологический материал вносят в лунки и оставляют на 15-30 минут для приклеивания антигенов к поверхности лунок. Затем в лунки вносят немеченые антитела к антигенам и оставляют на промежуток времени (1-5 часов), чтобы антитела связались со «своими» антигенами и образовали иммунный комплекс (первый этап). После чего удаляют «лишние», не связавшиеся антитела, путем выливания содержимого лунок. Производят промывку специальным раствором для полного удаления всех не связавшихся антител.
Связывание меченого антитела с комплексом антиген + немеченое антитело  После чего берут вторые антитела – меченые, добавляют в лунки и опять оставляют на некоторое время – 15-30 минут (второй этап). За это время меченые антитела связываются с первыми – не мечеными и образуют комплекс – антитело + антитело + антиген. Однако и меченые, и не меченые антитела вносятся в лунки в избытке. Поэтому нужно опять удалить «лишние», уже меченые антитела, которые не связались с немечеными антителами. Для этого повторяют процедуру выливания содержимого лунок и промывки специальным раствором.
После чего берут вторые антитела – меченые, добавляют в лунки и опять оставляют на некоторое время – 15-30 минут (второй этап). За это время меченые антитела связываются с первыми – не мечеными и образуют комплекс – антитело + антитело + антиген. Однако и меченые, и не меченые антитела вносятся в лунки в избытке. Поэтому нужно опять удалить «лишние», уже меченые антитела, которые не связались с немечеными антителами. Для этого повторяют процедуру выливания содержимого лунок и промывки специальным раствором.
Ферментативная реакция – образование окрашенного соединения
После чего вносят фермент, осуществляющий реакцию превращения «метки» в окрашенное вещество. Окраска развивается в течение 5-30 минут. Затем проводят колориметрию и вычисляют концентрацию окрашенного вещества. Поскольку концентрация окрашенного вещества равна концентрации меченых антител, а концентрация меченых равна концентрации немеченых антител, которая, в свою очередь равна концентрации антигена. Таким образом, получаем концентрацию выявляемого антигена.
Такой двойной контроль в виде использования двух видов антител позволил повысить чувствительность и специфичность метода иммуноферментного анализа. Несмотря на удлинение времени проведения анализа и включение дополнительных этапов, эти потери компенсируются точностью результата. Именно поэтому в настоящее время подавляющее большинство методик иммуноферментного анализа – это непрямой иммуноферментный анализ.
Какие заболевания выявляют методом иммуноферментной диагностики?
Перейдем к рассмотрению того, какие заболевания и какие биологически активные вещества выявляются методом иммуноферментного анализа. Вещества, выявляемые методом иммуноферментного анализа, представлены в таблице.
Иммуноферментный анализ, ИФА, ELISA ( enzyme-linked immunosorbent assay), ферментный иммуносорбентный анализ (лат. fermentum — закваска; лат. immunis — свободный, избавленный от чего-либо и sorbeo — поглощать; греч. analysis — разложение, расчленение) — высокочувствительный метод иммунохимического анализа на основе ферментсвязанного иммуносорбента, используемый для определения специфических антигенов в сложной смеси. В наиболее распространенном варианте этого теста применяют два препарата антител: первичные антитела, специфические для тестируемого белка, адсорбируют на твердую подложку, к которой добавляют определенное количество анализируемого образца; затем для выявления комплекса «антитело-антиген» добавляют вторичные антитела, специфичные для другого участка тестируемого белка, которые конъюгированы с ферментом. Фермент катализирует изменение окраски специального субстрата, добавляемого в последнюю очередь, что регистрируется фотометрически. Этот тест широко используется для диагностики различных заболеваний.
ИФА (ELISA) в различных модификациях этого метода используется для выявления вирус-специфических антигенов в крови, ликворе, органах и тканях больных людей и животных, а также в экспериментальных материалах (инфицированные клеточные культуры, органы лабораторных животных и т.п.). С помощью ИФА возможна идентификация выделенных вирусов. Методы ИФА широко используются для серологической диагностики вирусных инфекций, изучения иммуноструктуры населения, определения статуса гуморального иммунитета у вакцинированных и других целей7
Метод характеризуется высокой чувствительностью, специфичностью, экономичностью, быстротой выполнения. При необходимости реакция может быть поставлена в полевых условиях.
Для постановки ИФА необходимы следующие ингредиенты: специфические вирусные антигены, нормальные антигены, иммуноглобулины к М- и G-белкам человека, специфические и нормальные иммуноглобулины, положительные IgM или IgG позитивные сыворотки больных, нормальные сыворотки людей, пероксидазные конъюгаты глобулинов, карбонатно-бикарбонатный, фосфатный, цитратно-фосфатный буферы, раствор для отмывания лунок планшетов, хромоген (раствор тетраметилбензидина), раствор бычьего альбумина, перекись водорода, серная кислота. Реакцию ИФА выполняют в 96-луночных полистироловых планшетах, учитывая оптическую плотность в опытных и контрольных лунках на спектрофотометре с длиной волны 450 нм.
ИФА для определения специфических вирусных антигенов ("сэндвич"- ИФА). Принцип выявления антигенов вирусов в ИФА заключается в том, что специфические иммуноглобулины, прикрепленные к поверхности лунок полистироловых планшетов, сорбируют антиген из исследуемого образца и образуют иммунный комплекс со специфическим конъюгатом, что выявляется затем при добавлении субстрат-индикаторного раствора.
Этот метод позволяет выявить специфические антигены при содержании в обследуемых материалах инфекционного вируса не менее 1,0-2,5 Ig (ЛД50), или ТЦД50, или 10-150 БОЕ.
ИФА для выявления ("захвата") специфических иммуноглобулинов класса М (ИФА-IgM, MAC-ELISA). Принцип определения специфических антител класса М в сыворотках людей и животных заключается в "улавливании" этих антител иммуноглобулинами против IgM человеческой сыворотки, сорбированными на поверхности лунок, и образовании иммунного комплекса специфических антител, специфического антигена и конъюгата с последующим проявлением его в субстратно-индикаторном растворе.
На первом этапе постановки реакции лунки планшетов сенсибилизируют антителами (обычно козьими) против мю-цепи IgM человека. Данная модификация ИФА позволяет избежать ложноположительных результатов, связанных с наличием ревматоидного фактора . ИФА-IgM является методом серологической экспресс-диагностики, т.к. при многих острых вирусных инфекциях специфические IgM-антитела в сыворотке крови и ликворе появляются уже в первые дни заболевания, но исчезают, чаще всего, через 3-5 мес после выздоровления. Их титры достигают иногда (например, при лихорадке Западного Нила и клещевом энцефалите ) очень высоких значений — 1:102400-204800.
Обнаружение специфических IgM в однократно взятых сыворотках, а также выявление их сероконверсии в парных сыворотках указывают, как правило, на наличие острой первичной инфекции.
ИФА для определения специфических IgG — непрямой "сэндвич"-ИФА (ИФА-IgG). Данная модификация предназначена для обнаружения специфических IgG в сыворотках крови больных людей, реконвалесцентов, для изучения иммуноструктуры населения, определения показателей иммунитета у вакцинированных лиц и других целей.
Последовательность внесения специфических компонентов ИФА-IgG: иммуноглобулин->вирусные антигены->пероксидазный конъюгат гетерологичных антител (глобулинов) против IgG человека.
При проведении серологической диагностики в ИФА-IgG надо исследовать парные сыворотки больных с целью выявить сероконверсии антител.
ИФА для определения авидности IgG. Метод определения авидности IgG антител основан на том, что в процессе формирования IgG-антител, развитии гуморального иммунитета при заболевании и выздоровлении пропорция специфических высокоавидных антител возрастает. Поэтому присутствие низкоавидных IgG-антител указывает на первичный характер инфекции, тогда как высокоавидные IgG типичны для предшествующего заболевания, реактивации инфекции или повторной инфекции. Степень авидности IgG выявляется при сравнительном определении их активности методом ИФА-IgG в сыворотках, обработанных и необработанных мочевиной, и выражается как индекс авидности . Он представляет собой соотношение сигнала обработанной мочевиной сыворотки к сигналу необработанной. Авидность менее 30% считается низкой и рассматривается как признак острой первичной инфекции, имевшей место в течение последнего месяца после начала заболевания. Высокая авидность ( более 50%) указывает на анамнестический характер антител.
Современные подходы к совершенствованию иммуноферментных тест-систем заключаются в использовании рекомбинантных вирусных белков, концентрированных и очищенных антигенов (в качестве подложки) и антигенов, меченных пероксидазой хрена, а также в применении моноклональных антител и новых твердофазных носителей, позволяющих сократить время постановки реакции до 15-20 мин.
Твердофазный иммуноферментный анализ — надежный, экономичный и высокочувствительный метод. Он основан на использовании стандартных препаратов, очищенных антигенов или антител, ковалентно связанных с ферментом. Эти препараты сохраняют и иммунологические свойства, и ферментативную активность, которую можно измерить при добавлении субстрата данного фермента.
