Неоплазия высокой степени
Содержание:
Доброкачественные (зрелые, гомологичные) опухоли состоят из клеток, дифференцированных в такой мере, что можно определить, из какой ткани они растут. Для этих опухолей характерен медленный экспансивный рост, отсутствие метастазов, отсутствие общего влияния на организм. Доброкачественные опухоли могут малигнизироваться (превращаться в злокачественные).
Злокачественные опухоли
Злокачественные (незрелые, гетерологичные) опухоли состоят из умеренно- и малодифференцированных клеток. Они могут утратить сходство с тканью, из которой они исходят. Для злокачественных опухолей характерен быстрый, чаще инфильтрирующий, рост, метастазирование и рецидивирование, наличие общего влияния на организм. Для злокачественных опухолей характерен как клеточный (утолщение и атипизм базальной мембраны, изменение соотношения объемов цитоплазмы и ядра, изменение ядерной оболочки, увеличение объема, а иногда и числа ядрышек, увеличение числа фигур митоза, атипизм митоза и др.), так и тканевой атипизм (нарушение пространственных и количественных соотношений между компонентами ткани, например, стромой и паренхимой, сосудами и стромой и т. д.).
Типы роста опухолей
В зависимости от характера взаимодействия растущей опухоли с элементами окружающей ткани:
- экспансивный рост — опухоль растет «сама из себя», раздвигая окружающие ткани, ткани на границе с опухолью атрофируются, происходит коллапс стромы — формируется псевдокапсула;
- инфильтрирующий (инвазивный, деструирующий) рост — клетки опухоли врастают в окружающие ткани, разрушая их;
- аппозиционный рост опухоли происходит за счет неопластической трансформации клеток окружающей ткани в опухолевые.
В зависимости от отношения к просвету полого органа:
- экзофитный рост — экспансивный рост опухоли в просвет полого органа, опухоль закрывает часть просвета органа, соединяясь с его стенкой ножкой;
- эндофитный рост — инфильтрирующий рост опухоли вглубь стенки органа.
В зависимости от числа очагов возникновения опухоли:
- уницентрический рост — опухоль растет из одного очага;
- мультицентрический рост — рост опухоли из двух и более очагов.
Метастазирование опухолей
Метастазирование — процесс распространения опухолевых клеток из первичного очага в другие органы с образованием вторичных (дочерних) опухолевых очагов (метастазов). Пути метастазирования:
- гематогенный — путь метастазирования при помощи опухолевых эмболов, распространяющихся по кровеносному руслу;
- лимфогенный — путь метастазирования при помощи опухолевых эмболов, распространяющихся по лимфатическим сосудам;
- имплантационный (контактный) — путь метастазирования опухолевых клеток по серозным оболочкам, прилежащим к опухолевому очагу.
- интраканикулярный — путь метастазирования по естественным физиологическим пространствам (синовиальные влагалища и.т.д.)
- периневрально (частный случай интраканикулярного метастазирования)- по ходу нервного пучка.
Для разных опухолей характерны разные типы метастазирования, разные органы, в которые происходит метастазирование, что определяется взаимодействием рецепторных систем опухолевых клеток и клеток органа-мишени. Гистологический тип метастазов такой же, как и опухоли в первичном очаге, однако, опухолевые клетки метастазов могут становиться более зрелыми или, наоборот, менее дифференцированными. Как правило, метастатические очаги растут быстрее первичной опухоли, поэтому могут быть крупнее ее.
Влияние опухоли на организм
- Местное влияние заключается в сдавлении или разрушении (в зависимости от типа роста опухоли) окружающих тканей и органов. Конкретные проявления местного действия зависят от локализации опухоли.
- Общее влияние на организм характерно для злокачественных опухолей, проявляется различными нарушениями метаболизма, вплоть до развития кахексии.
Этиология опухолей
Этиология опухолей до настоящего времени неизвестна. Единой теории опухолей нет.
- Вирусно-генетическая теория решающую роль в развитии опухолей отводит онкогенным вирусам, к которым относят: герпесоподобный вирус Эпштейна-Барр (лимфома Беркитта), вирус герпеса (лимфогранулематоз, саркома Капоши, опухоли головного мозга), папилломавирус (рак шейки матки), ретровирус (хронический лимфолейкоз), вирусы гепатитов B и C (рак печени). Согласно вирусно-генетической теории интеграция генома вируса с генетическим аппаратом клетки может привести к опухолевой трансформации клетки. При дальнейшем росте и размножении опухолевых клеток вирус перестает играть существенную роль.
- Физико-химическая теория основной причиной развития опухолей считает воздействие различных физических и химических факторов на клетки организма (рентгеновское и гамма-излучение, канцерогенные вещества), что приводит к их онкотрансформации. Помимо экзогенных химических канцерогенов рассматривается роль в возникновении опухолей эндогенных канцерогенов (в частности, метаболитов триптофана и тирозина) путем активации этими веществами протоонкогенов, которые посредством синтеза онкобелков приводят к трансформации клетки в опухолевую.
- Теория дисгормонального канцерогенеза рассматривает в качестве причины возникновения опухолей различные нарушения гормонального равновесия в организме.
- Дизонтогенетическая теория причиной развития опухолей считает нарушения эмбриогенеза тканей, что под действием провоцирующих факторов может привести к онкотрансформации клеток ткани.
- Полиэтиологическая теория объединяет все вышеперечисленные теории.
Классификация опухолей
Классификация по гистогенетическому принципу (предложена Комитетом по номенклатуре опухолей):
- эпителиальные опухоли без специфической локализации (органонеспецифические);
- эпителиальные опухоли экзо- и эндокринных желез, а также эпителиальные опухоли покровов (органоспецифические);
- мезенхимальные опухоли;
- опухоли меланинобразующей ткани;
- опухоли нервной системы и оболочек мозга;
- опухоли системы крови;
- тератомы.
Классификация по системе TNM
Данная классификация использует числовое обозначение различных категорий для обозначения распространения опухоли, а также наличия или отсутствия локальных и отдаленных метастазов.
T — tumor
От латинского слова tumor — опухоль. Описывает и классифицирует основной очаг опухоли.
- Tis или T — так называемая карцинома «in situ» — то есть не прорастающая базального слоя эпителия.
- T1-4 — различная степень развития очага. Для каждого из органов существует отдельная расшифровка каждого из индексов.
- Tx — практически не используется. Выставляется только на время, когда обнаружены метастазы, но не выявлен основной очаг.
N — nodulus
От латинского nodulus — узел. Описывает и характеризует наличие регионарных метастазов, то есть в регионарные лимфатические узлы.
- Nx — выявление регионарных метастазов не проводилось, их наличие не известно.
- N — Регионарных метастазов не обнаружено при проведении исследования с целью обнаружения метастазов.
- N1 — Выявлены регионарные метастазы.
M — metastasis
Характеристика наличия отдаленных метастазов, то есть — в отдаленные лимфоузлы, другие органы, ткани (исключая прорастание опухоли).
- Mx — выявление отдаленных метастазов не проводилось, их наличие неизвестно.
- M — Отдаленных метастазов не обнаружено при проведении исследования с целью обнаружения метастазов.
- M1 — Выявлены отдаленные метастазы.
Для некоторых органов или систем применяются дополнительные параметры (P или G, в зависимости от системы органов), характеризующие степень дифференцировки ее клеток.
См. также
Опухоли и онкология
Голова и шея • ЦНС • Головной мозг • Глаза • Полость рта • Гортань • Щитовидная железа • Пищевод • Желудок • Двенадцатиперстная кишка • Печень • Желчный пузырь • Поджелудочная железа • Толстая кишка • Прямая кишка • Анус • Лёгкие • Средостение • Почки • Мочевой пузырь • Эндометрий • Шейка матки • Яичники • Молочная железа • Простата • Яички • Половой член • Кожа • Кости
Папиллома • Карцинома • Хориокарцинома • Аденома • Аденокарцинома • Саркома мягких тканей • Меланома • Фиброма • Фибросаркома • Метастаз • Липома • Липосаркома • Лейомиома • Лейомиосаркома • Рабдомиома • Рабдомиосаркома • Мезотелиома • Невринома • Менингиома • Ангиома • Ангиосаркома • Остеома • Остеосаркома • Хондрома • Хондросаркома • Глиома • Лимфома • Лейкоз
структуры
Гены опухолевой супрессии • Онкоген • Стадирование • Градации • Канцерогенез • Канцероген • Исследования • Паранеопластические феномены • МКБ-О • Список онкологических терминов
Wikimedia Foundation . 2010 .
Смотреть что такое "Неоплазия" в других словарях:
неоплазия — Возникновение и развитие новой, обычно опухолевой, ткани [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN neoplasia … Справочник технического переводчика
неоплазия — (нео. гр. plash образование) иначе неоплазма, бластома новообразование ткани, опухоль. Новый словарь иностранных слов. by EdwART, , 2009. неоплазия и, мн. нет, ж. (нем. Neoplasie … Словарь иностранных слов русского языка
неоплазия — неоплаз ия, и … Русский орфографический словарь
неоплазия — (1 ж), Р., Д., Пр. неоплази/и … Орфографический словарь русского языка
Неоплазия — (нео греч. plasis – образование) – опухоль, новообразование ткани (неоплазма, бластома) … Энциклопедический словарь по психологии и педагогике
НЕОПЛАЗИЯ — [см. нео греч. plasis образование] иначе неоплазма, бластома новообразование ткани, опухоль … Психомоторика: cловарь-справочник
Неоплазия Интраэпителиальная Цервикальная (Цин) (Cervical Intraepithelial Neoplasia, Cin) — клеточные изменения, происходящие в шейке матки перед наступлением инвазивных стадий цервикального рака. Различают три стадии ЦИН: ЦИН 1 (слабая дисплазия); ЦИН 2 (умеренная дисплазия) и ЦИН 3 (сильная дисплазия, развитие карциномы). ЦИН… … Медицинские термины
НЕОПЛАЗИЯ ИНТРАЭПИТЕЛИАЛЬНАЯ ЦЕРВИКАЛЬНАЯ (ЦИН) — (cervical intraepithelial neoplasia, CIN) клеточные изменения, происходящие в шейке матки перед наступлением инвазивных стадий цервикального рака. Различают три стадии ЦИН: ЦИН 1 (слабая дисплазия); ЦИН 2 (умеренная дисплазия) и ЦИН 3 (сильная… … Толковый словарь по медицине
Множественная эндокринная неоплазия — МКБ 10 D44.844.8 МКБ 9 258.0258.0 МКБ О … Википедия
ХОРИОНЭПИТЕЛИОМА — мед. Хорионэпителиома злокачественная опухоль, растущая в матке из трофобласта развивающейся бластоцисты и проявляющаяся после пузырного заноса, абортов или во время нормальной беременности. Сохраняет инвазивный характер роста нормальной плаценты … Справочник по болезням
Введение
Возможность эндоскопического лечения раннего рака толстой кишки обсуждается уже давно. Общепринятым фактом считается достаточность удаления опухоли в пределах здоровых тканей при раке ограниченном слизистой оболочкой. Мнения по эндоскопическому лечению раннего инвазивного колоректального рака (КРР) варьируют от полного отрицания такой возможности [2] до оценки эндоскопического удаления как радикального во всех случаях, когда опухоль удалена в пределах здоровых тканей [8] . Оба этих подхода в настоящее время имеют только историческое значение. Данный обзор посвящен современным взглядам на эндоскопическое лечение раннего инвазивного рака толстой кишки.
Терминология
Ранний рак толстой кишки это аднокарцинома ограниченная слизистой или подслизистым слоем [7] .
Согласно переработанной Венской классификации [4] в понятие ранний рак могут быть включены пункты 4-2, 4-3, 4-4 и 5 (рис. 1). 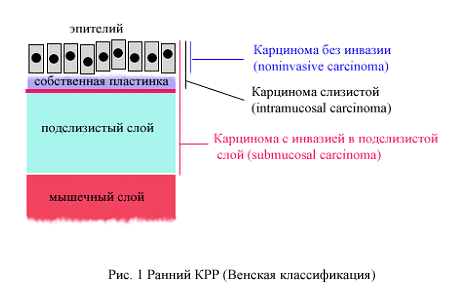
Венская классификация:
- Без интроэпителиальной неоплазии.
- Сомнительная интроэпителиальная неоплазия.
- Интроэпителиальная неоплазия низкой степени.
- Аденома/дисплазия.
- Неоплазия высокой степени без инвазии (интроэпителиальная или внутрислизистая).
- Аденома/дисплазия.
- Неинвазивная карцинома.
- Подозрение на инвазивную карциному.
- Внутрислизистая карцнома (инвазия в собственную пластинку).
Макроскопическая классификация раннего рака толстой кишки соответствует парижской классификации эпителиальных неоплазий приведенной на рис. 2. 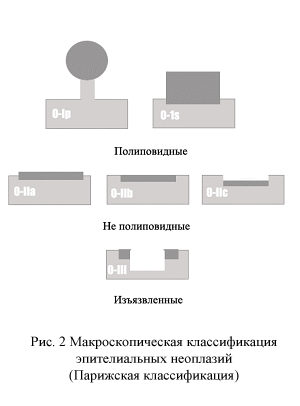
Как в случае хирургического так и эндоскопического лечения рака толстой кишки опухоль должна быть удалена в пределах здоровых тканей. Однако, в отличие от хирургического лечения при эндоскопической резекции слизистой регионарные лимфатические узлы удалены быть не могут. Таким образом, местное удаление опухоли показано только пациентам с минимальным риском метастазирования в региональные лимфатические узлы.
Основным критерием полноты местного удаления опухоли считается расстояние от границы резекции до нижнего края опухоли. Существуем мнение о минимальном расстоянии в 2 мм [19] , 1 мм [3] или просто отсутствие опухолевых клеток по границе коагуляционного повреждения тканей [17] . Мы в своей работе придерживаемся последнего подхода т.к. считаем, что два других значительно увеличивают число пациентов подвергающихся необоснованной лапаротомии.
Факторы риска
Лимфатические сосуды не распостраняются на слизистую оболочку толстой кишки, а присутствуют только в подслизистом и мышечном слое [6] . Таким образом не инвазивные (т.е. не распространяющиеся на мышечную пластинку слизистой) карциномы не могут давать метастазы в регионарные лимфатические узлы и следовательно для них эндоскопическое удаление всегда радикально (при условии, что местно опухоль удалена в пределах здоровых тканей).
Ряд факторов рассматривается в качестве возможных индикаторов наличия или отсутствия метастазов в региональные лимфатические узлы при раннем инвазивном КРР. Это качественные критерии, как: степень дифференцировки опухоли, наличие или отсутствие инвазии в сосуды, отсевы и макроскопический тип раннего КРР. Единственным количественным фактором риска поражения лимфатических узлов является глубина подслизистой инвазии.
Дифференцировка опухоли
Считается общепризнанным, что низкая дифференцировка опухоли является независимым фактором риска метастазирования в лимфатические узлы и гематогенной диссеминации [9, 11, 16, 17] . Правда, по некоторым данным, встречается она не более чем в 10 % случаев раннего рака толстой кишки и чаще всего в сочетании с другими факторами риска [11] . Наибольшую роль играет дифференцировка опухоли в месте наиболее глубокой полслизистой инвазии.
Инвазия в сосуды
Под инвазией в сосуды подразумевается инвазия в лимфатические или венозные сосуды (рис. 3). 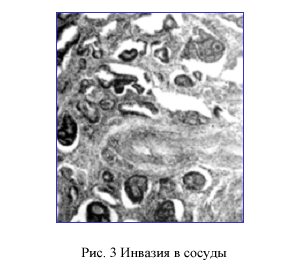
По данному вопросу существует два противоположенных подхода. Так Nedzer считает, что венозная инвазия сама по себе не может рассматриваться в качестве изолированного фактора обуславливающего выполнение лапаротомии при раннем КРР [11] . Он также полагает, что изолированная инвазия в лимфатические сосуды встречается редко. Существует и мнение о сложности дифференциального диагноза между лимфатической и венозной инвазией или артефактами [18] .
По другим данным необходимость дифференцировки между венозной или лимфатической инвазией отсутствует, а сосудистая инвазия сама по себе является фактором риска наличия метастазов в лимфатических узлах [17] . Подобного мнения придерживаются и Egashira et al. [5] и Yamamoto S., et al. [20] .
Мы в своей работе также рассматриваем сосудистую (не зависимо лимфатическую или венозную) инвазию в качестве независимого фактора риска метастазирования в лимфатические узлы.
Отсевы
Отсевы это изолированные клетки опухоли или группы клеток расположенные в других отношениях здоровых тканях (рис. 4). 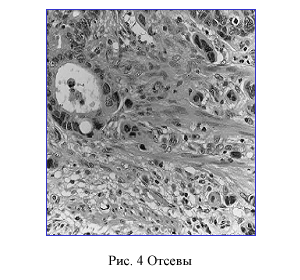
Отсевы могут рассматриваться в качестве начальной формы инвазии, предшествующей сосудистой инвазии. Она является независимым фактором риска поражения лимфатических узлов не только при раннем, но и распространенном КРР [12, 14] .
Макроскопический тип опухоли
Ряд исследователей полагает, что плоские формы раннего КРР связанны с большим риском метастазирования в лимфатические узлы, чем полиповидные опухоли [10] . Однако по другим данным такая взаимосвязь отсутствует [1, 14] .
Мы в своей практике не рассматриваем макроскопический тип в качестве независимого фактора риска метастазирования в лимфатические узлы, признавая однако, что опухоли с компонентом типа 0-IIc чаще имеют большую глубину инвазии в подслизистый слой, чем другие макроскопические типы. Однако большая вероятность метастазирования в этом случае будет связана с большей глубиной инвазии, а не с типом опухоли самой по себе.
Глубина инвазии
Глубина инвазии это расстояние от мышечной пластинки слизистой (или ее предположительного расположения) до наиболее глубоко лежащей границы опухоли (рис. 5). 
Nagasako K., сообщал об отсутствии метастазов в лимфатические узлы при инвазии в подслизистый слой глубиной до 500мкм и шириной до 2000мкм (инвазия типа sm-s). Однако по другим данным даже такая минимальная степень инвазии может сочетаться с наличием метастазов в лимфатические узлы. Так Tanaka S., et al., выявил метастазы в лимфатические узлы у 4 % пациентов с таким типом инвазии [15] .
Заключение
В настоящее время практически невозможно упомянуть все исследования посвященные факторам риска метастазирования в регионарные лимфатические узлы при раннем инвазивном КРР. Мы остановимся лишь на некоторых из них опубликованных японскими авторами (как обладающими наибольшим опытом в изучении этой проблемы) в 2000 – 2004 годах.
Таким образом, основываясь на представленных данны, по нашему мнению можно считать безопастным эндоскопическое удаление раннего КРР у пациентов с сочетанием следующих признаков (при условии отсутствия опухолевых клеток на уровне резекции):
- Аденокарциномой высокой или средней степени дифференцировки.
- Без инвазии в лимфатические или венозные сосуды.
- Без наличия отсевов.
- С глубиной инвазии не более 1500мкм (при подслизистой инвазии до 2000 мкм риск метастазирования в лимфатические узлы видимо также минимален и выбор хирургического или эндоскопического лечения должен проводиться на основе его сравнительной оценки с риском хирургического вмешательства для данного конкретного больного).
Отсутствие любого из признаков 1-3 требует выполнения хирургического вмешательства по поводу раннего инвазивного КРР всем пациентам.
Данная проблема продолжает интенсивно изучаться во всем мире и подходы к радикальному эндоскопическому лечению раннего КРР продолжают меняться по мере поступления новой информации.
Онкология – самое распространенное заболевание современности. Ему подвержены и взрослые, и дети, а потому все силы медиков брошены на изобретение методов, способных распознать заболевание на ранних стадиях, когда его успешное лечение еще возможно.
Одним из распространенных недугов являются новообразования мужской половой системы. Им предшествует неоплазия – состояние, при котором клетки подвергаются генетическим изменениям, провоцирующим их неправильный рост. Такой патологический процесс является предвестником развития опухоли в предстательной железе мужчины.

Как распознать заболевание
Сегодня существуют множество методик, позволяющих выявить патологии мужской половой системы на ранних этапах их образования. Такие способы носят название скрининговых, то есть проводимых для профилактики той или иной болезни. Благодаря им специалисты получают возможность не только обнаружить недуг, но и уточнить стадию его развития. Для диагностики онкологических процессов простаты применяют такие исследования:
- анализ крови на ПСА (простатспецифический антиген, выделяемый клетками опухоли);
- трансректальное звуковое исследование предстательного органа;
- биопсия клеток новообразования;
- пальцевый ректальный осмотр.

Все «наружные» методики применяются только для обнаружения неоплазии и определения локализации и размеров опухоли. Дать ответ на вопрос, злокачественная ли она, может только гистологическое исследование тканей новообразования, полученных при помощи биопсии.
Для того чтобы своевременно обнаружить недуг, каждый мужчина старше сорока лет должен регулярно проходить профилактический осмотру у уролога. Если врач обнаружит увеличение размеров простаты, пациенту будут назначены дополнительные обследования и анализы.
Что такое ПИН
В урологии существует такое понятие как простатическая интраэпителиальная неоплазия (ПИН). Многие пациенты ошибочно считают, что это установленный диагноз. По факту, ПИН – это заключение, полученное в результате диагностики микропрепаратов, содержащихся в тканях предстательной железы.

Установленная простатическая неоплазия означает, что клетки эпителия простаты и самого органа (железистые) не соответствуют здоровым параметрам, имеют аномальную структуру, но в то же время не соответствуют показателям, отличающим злокачественные клетки. Говоря простым языком, в органе обнаружена опухоль (неоплазия), но она не является раковой.
В то же время с точностью утверждать, что обнаруженное новообразование не станет злокачественным, нельзя. Согласно статистическим данным, перерождение такого новообразования в злокачественное случается более чем в 85% случаев.
Поэтому специалисты относят простатическую интраэпителиальную неоплазию к тяжелым и серьезным диагнозам, требующим обязательного и длительного лечения.
В урологии принято объединять такие диагнозы как ПИН и онкология предстательной железы, хотя по факту это две различных патологии. Такой подход объясняется тем, что неоплазия рано или поздно обязательно перерастет в раковую опухоль. Но до того момента, пока это не случилось, у пациента есть все шансы избавиться от тяжелого недуга и стать здоровым.

Поэтому откладывать с лечением не стоит: по статистике, в 40% случаев гистологическое исследование клеток опухоли удаленной простаты пациентов с диагнозом ПИН после операции показывало злокачественное новообразование.
Виды простатической интраэпителиальной неоплазии
Диагноз ПИН всегда включает определение степени данного недуга. До начала XXI века в медицине разделяли две степени патологии – первую (низкую) и вторую (высокую). При интраэпителиальной неоплазии низкой степени изменения в клетках железы и эпителия выражены незначительно. Поэтому точно утверждать, что опухоль является предвестником рака, нельзя. Такое состояние может быть вызвано следующими патологиями:
- воспалительными процессами предстательной железы, имеющими хронический характер (простатит, инфекционные болезни и т. д.);
- гиперплазией предстательной железы доброкачественного характера (аденома простаты);
- развивающимся онкологическим новообразованием.
 Простатит
Простатит
Низкая степень ПИН — это пограничное состояние, и какой характер оно приобретет в дальнейшем, спрогнозировать очень тяжело. Вероятность перерождения в рак составляет не более 50%.
При второй, высокой степени ПИН наблюдается больше признаков, свидетельствующих о перерождении клеток предстательного органа в злокачественные.
Данная классификация сегодня практически не используется. Современные специалисты разделяют не степени, а виды интраэпителиальной неоплазии, основываясь на протекающих в клетках органа процессах. Так, онкологическая урология выделяет:
- атипическую гиперплазию;
- непосредственно ПИН;
- клеточную атипию (раковую опухоль).
При гиперплазии атипического характера изменения в клетках простаты соответствуют проявлениям интраэпителиальной неоплазии низкой степени. Как показывают исследования, вероятность перерождения таких клеток в раковые довольно мала и составляет не более 20% случаев.
Второй вид патологии, сама ПИН, сегодня соответствует второй степени патологии. В этом случае шансы, что новообразование приобретет злокачественный характер, очень велики. Случаев, когда ПИН не становилась раковой, зафиксировано менее 15%, и объясняется это тем, что между диагностикой и удалением новообразования прошло очень мало времени (несколько дней).
Более чем в 85% случаев у пациентов, диагноз которых звучал как ПИН, после операции гистология опухоли показывала такое заключение как рак простаты.
Третья классификация – клеточная атипия, не рассматривается онкоурологами как классификация неоплазии. Это уже окончательный диагноз, подтверждающий наличие у пациента раковой опухоли. Терапия и прогноз на выздоровление зависят от множества факторов, характеризующих здоровье пациента.
Согласно данным ВОЗ, разделение ПИН на степени не способно отразить истинных характеристик состояния новообразования. Поэтому результаты диагностики включают такие понятия как рак или предраковое состояние с высоким риском перерождения.
Причины развития неоплазии
Точные причины, почему здоровые клетки подвергаются генетическим изменениям и начинают разрастаться, доподлинно не известны. Но медики выделяют ряд факторов, способных спровоцировать такие процессы в организме.

Основными из них являются:
- наследственность;
- хронические воспалительные процессы в простате;
- дефицит микроэлементов;
- инфекции половых путей.
Так, у мужчин, чьи кровные родственники страдали онкологией половой системы, риск развития рака простаты в несколько раз выше. Также к основным причинам развития неоплазии относят длительные воспаления, протекающие в предстательном органе представителей сильного пола.
Они могут быть вызваны хроническим простатитом или инфекционными болезнями, которым не уделяется должное внимание, или чье лечение не было проведено своевременно.
Такие микроэлементы как цинк, селен, магний, витамины В и Е незаменимы для мужского здоровья. Их недостаток приводит к нарушению процессов метаболизма в клетках, что становится причиной генетических изменений в них и появления аномальных изменений.
Медики выделяют группы пациентов, у которых при отсутствии вышеописанных факторов также существует высокий риск развития злокачественных новообразований половой системы.

Данное заболевание чаще встречается у представителей сильного пола старше 60 лет, у молодых мужчин, долгие годы работающих на вредном производстве и подвергающихся радиационному излучению. Низкий иммунитет тоже провоцирует развитие онкологии.
Зафиксировано, что пациенты, проживающие в районах с недостатком солнечного света, чаще страдают простатической интраэпителиальной неоплазией, чем те, кто живет в жарком климате. Неправильное питание, а именно переизбыток животной пищи в рационе также относят к факторам риска развития ПИН.
Диагностика ПИН
Опасность ПИН заключается в несвоевременной ее диагностике. Если первые две стадии еще подлежат лечению, то шансы на выздоровление пациентов с диагнозом «клеточная атипия» ничтожно малы. Поэтому каждому пациенту старше 40 лет показаны скрининговые обследования, способные обнаружить патологию в самом начале ее развития.
Одним из популярных и эффективных методов ранней диагностики является анализ крови на ПСА. Простатспецифический антиген входит в группу онкомаркеров, свидетельствующих о развитии злокачественных новообразований в половой системе, а именно — в предстательной железе.
ПСА относится к косвенным признакам наличия ПИН, поскольку при данной патологии он увеличивается незначительно. Но присутствие повышенного онкомаркера послужит поводом для прохождения других, более информативных обследований.
Если уровень ПСА в крови пациента даже незначительно превышает допустимые значения, специалист обязательно назначит «визуальные» методы диагностики органов малого таза мужчины. Самый популярный и доступный из них – ультразвуковая диагностика, проводимая абдоминально и ректально. Датчик, вводимый в задний проход мужчины, находится рядом с пораженным органом, что позволяет детально рассмотреть простату, обнаружить новообразования в ней и определить их основные характеристики (размеры, контуры, плотность и другие).

Если данные ТРУЗИ недостаточно информативны или требуют подтверждения, больному предложат пройти современные методы обследования – компьютерную или магнитно-резонансную томографию. Такая диагностика предоставит снимки органа с разных сторон, в нескольких срезах и под всем углами.
Дополнить данные визуальных диагностик поможет биопсия тканей предстательной железы. Забор биоматериала выполняют под местной анестезией, а потом изучают клетки под микроскопом на предмет аномального строения.
Прямым показанием к выполнению биопсии может стать повышенный уровень ПСА в крови или быстрое увеличение показателей в динамике. Обычно такое явление характерно для аденомы предстательной железы (доброкачественной гиперплазии), у которой также есть высокий риск со временем перерасти в раковую опухоль.
Лечение неоплазии

На сегодняшний день нет точной методики лечения. Терапия зависит от множества факторов: вида патологии, наличия других заболеваний половой системы, присутствия хронических болезней других внутренних органов, общего состояния здоровья пациента, его возраста. Но существует алгоритм, которого придерживаются урологи при обнаружении данного заболевания.
В первую очередь, больной ставится на диспансерный учет у уролога. Он включает регулярное посещение врача, ректальные осмотры и сдачу необходимых анализов не реже, чем раз в месяц. Такое наблюдение позволит контролировать динамику патологии и предпринять необходимые меры в случае ухудшения здоровья пациента. Визуальные обследования (обычно ТРУЗИ) проводятся каждые полгода, при необходимости – чаще. Биопсия тканей предстательной железы должна проводиться не реже, чем раз в год.
ВАЖНО. Если наблюдается отрицательная динамика (опухоль растет, анализы показывают увеличение уровня ПСА и т. д.), частота обследований может быть увеличена.

Самым распространенным способом лечения ПИН сегодня остаются лучевая и гормональная терапия.
Последний вид лечения показывает высокие результаты, потому что злокачественные клетки имеют высокую чувствительность к изменению гормонального фона: если синтез данных веществ стабилизируется, клетки перестают перерождаться и возвращаются к здоровым параметрам. Терапия направлена на повышение уровня тестостерона в крови и уменьшение его воздействия на аномальные клетки простаты.
На сегодняшний день лечение гормонами – это предпочтительная терапия неоплазии. К сожалению, избавиться от нее полностью удается лишь малой части пациентов, но замедлить процесс ее развития возможно, а вместе с тем и продлить полноценную жизнь пациенту.

Занимается диагностикой и лечением таких заболеваний кожи, как псориаз, акне (угри), розацеа, себорея, экзема, дерматит (аллергический, атопический, контактный, нейродермит), лишаи различного типа.
