Окраска по нейссеру дифтерия
Материалом для исследования при дифтерии могут быть пленки и слизь из зева и носа, а при редких локализациях дифтеритических воспалений — из глаза, уха, с поверхности раны и кожи. Отделяемое забирают сухим ватным тампоном или смоченным 5% раствором глицерина в физиологическом растворе с рН-8.
До этого уровня его доводят 20% раствором однозамещенного фосфорно-кислого натрия (Na2HPO4).
Исследование осуществляют не позднее 3-4 часов после забора, с поэтапной выдачей ответов о подтверждении диагноза.
I. МИКРОСКОПИЧЕСКИЙ МЕТОД
Морфологические и тинкториальные признаки дифтерийных бактерий настолько своеобразны, что микроскопический метод может примениться как самостоятельный или предварительный к бактериологическому анализу. Кроме того, он дает представление и о сопутствующей микрофлоре.
Для выявления дифтерийных палочек могут быть использованы три метода окраски: Грама, Леффлера, Нейccера.
МЕТОД ГPAМA позволяет выявить способность дифтерийных бактерий вступить во взаимодействие с генцианвиолетом. Дифтерийные бактерии грампозитивиы, но это свойство непостоянно. При контакте с антибиотиками, при длительном пребывании в голодной среде резко изменяется обмен веществ и грамположительность микробов теряется. Поэтому ориентироваться на этот признак нельзя.
МЕТОД НЕЙССЕРА — наиболее ценный дифференциально-диагностический способ, позволяющий не только окрасить микроорганизмы, но и выявить полярно вкрапленные зерна волютина и характерное расположение бактериальных особей под углом.
РЕАКТИВЫ
- УКСУСНОКИСЛАЯ СИНЬКА НЕЙСЕРА: метиленовая синька -0,1 г, спирт 96° -2 мл; 5% раствор ледяной уксусной кислоты в дистиллированной воде — 50 мл.
- РАСТВОР ЛЮГОЛЯ: 2 г йодистого калия растворить в 10 г дистиллированной воды. Затем к этому раствору прибавить; 1 г кристаллического йода и добавить воды до 300 мл.
- РАСТВОР ХРИЗОИДИНА: 2 г хризоидина на 300 мл горячей дистиллированной воды.
Вместо раствора хризоидина можно использовать раствор везувина (краситель бисмаркбраун): везувин-1 г; 96° cпирт-10 мл; кипящая дистиллированная вода-100 мл.
ТЕХНИКА ОКРАСКИ
- Синька Нейссора- 1 минута
- Раствор Люголя — 30 секунд.
- Ополаскивание дистиллированной водой.
- Докраска расвором хризоидина или везувина — 10-15 секунд.
Тело микробной клетки окрашивается в желтый или желто-коричневый цвет, зерна волютина — коричнево-черного цвета.
ОКРАСКА ПО СПОСОБУ ЛЕФФЛЕРА
Метод Леффлера прост, но по своим дифференциально-диагностическим возможностям он не уступает сложному способу Нейссера. Поэтому он применяется значительно чаще.
Для окраски нужен один реактив — щелочная метиленовая синька Леффлера следующего состава: Дистиллированная вода — 99 мл; 1% раствор едкого калия (КОН) — 1 мл; профильтрованный спиртовой раствор метиленовой синьки (0,5 г синьки на 30 мл спирта) — 30 мл.
Окраска осуществляется 1-2 минуты. При этом тело бактерий приобретает бледно-голубой цвет, зерна волютина — синий или cине-черный.
При выполнении микроскопического исследования важно отличить истинные дифтерийные бактерии от дифтериеподобных палочек Гоффмана и бактерий ксерозис.
| Микроскопическая дифференциация дифтерийных бактерий и дифтероидов | ||
| Бактерии | Взаимное расположение особей в препарате | Наличие и количество зерен волютина |
| Дифтерии | Под углом в виде римской цифры V или кисти рук с разведенными пальцами | 2 зерна с полярной локализацией |
| Бактерии Гоффмана | Параллельное, в виде часткола | Зерен нет или единичные без типичной локализации |
| Бактерии Keepоза | Хаотичное | Зерен много, распределение беспорядочное |
II. БАКТЕРИОЛОГИЧЕСКИЙ МЕТОД
Дифтерийные бактерии требовательны к питательным средам. Для их выделения и накопления используется комплекс специальных элективных и дифференциально-диагностических сред.
СВЕРНУТАЯ СЫВОРОТКА РУ: 3 мл стерилыной сыворотки лошади (быка или человека) вносят в пробирку, укладывают с наклоном в 45-50° в свертывателе Коха, предварительно нагретом до +50 °C. Затем температуру доводят до 80° и прогревают в течение 1 часа. Готовую среду охлаждают, ставят в термостат для проверки стерильности. В случае прорастания среды последнюю повторно прогревают при + 80 °C в течение 2 часов.
На этой среде бактерии дают шероховатые R-формы, напоминающие в комплексе шагреневую кожу.
ТЕЛЛУРИТОВЫЕ ДИФФЕРЕНЦИАЛЬНЫЕ СРЕДЫ
Дифтерийные бактерии обладают выраженной способностью восстанавливать теллуровокислый калий до металлического теллурита. Для выявления этой способности в среды добавляется дифференцирующий компонент-2% раствор теллурита калия следующего состава: дистиллированная вода-100 мл; теллурит калия (K2FeO4)-2 г. Раствор стерилизуют кипячением 30 минут. Для приготовления сред можно использовать также готовый 2% раствор теллурита калия в 40% глицерине, выпускаемый в ампулах для клинических теллуритовых проб.
СЫВОРОТОЧНО-ТЕЛЛУРИТОВЫИ АГАР: к 80 мл расплавленного и охлажденного до +50 °C 2% МПА добавляют 20 мл лошадиной или 30 мл бычьей сыворотки и 1 мл 2% раствора теллурита калия. Готовую среду разливают в стерильные чашки.
КРОВЯНО-ТЕЛЛУРИТОВЫЙ АГАР: к 100 мл расплавленного и охлажденного до +50 °C 2-3% МПА добавляют 5-10% дефибринированной крови человека (донорской, плацентарной) или животного (крупного рогатого окота, кролика, барана, морской свинки) и 1 мл 2% теллурита калия, смешивают и разливают в чашки.
СРЕДА КЛАУБЕРГА: 100 мл 3% МПА расплавляют, добавляют 3 мл 2% теллурита калия, 10 мл глицериновой смеси и 50 мл лаковой крови. Последнюю готовят следующим образом: к 34 мл дистиллированной стерильной воды добавляют 16 мл дефибринированной крови (любой). Состав глицериновой смеси: к 40 мл дефибринироваиной крови крупного рогатого скота или человека добавляют 20 мл химически чистого стерильного глицерина и выдерживают до употребления в холодильнике 3-6 недель.
По характеру роста на теллуритовых средах удается отдифференцировать дифтерийные бактерии как внутри вида, так и от других микроорганизмов.
| Дифференциация дифтерийных палочек от других микробов на теллуритовых и хинозольной средах | ||
| Бактерии | Характер роста на средах | |
| теллуритовых | хинозольной | |
| Дифтерийные бактерии | серые, розеткообразные | синие |
| тип гравис | с радиальностью | |
| тип митис | черные, матовые, гладкие | |
| тип интермедиус | серо-черные, гладкие | |
| Ложнодифтерийные бактерии Гофмана | серые, блестящие, выпуклые, конусовидные | голубоватые |
| Дифтериоиды Ксероза | серо-черные, как истинные дифтерийные | бесцветные |
| Стафилококки | черные, влажные, блестящие | — |
ХИНОЗОЛЬНУЮ СРЕДУ БУЧИНА готовят по следующей прописи: на 100 мл воды добавляют 3 г хлористого натрия, 1,5 г, глюкозы, 1 мл 3% раствора цистина в 1% растворе соды, 2 мл водного раствора хинозола (1:1000), 0,08 г индикатора водноголубого, 4,0 сухого питательного агара. Смесь растворяют при нагревании. Устанавливают pH = 7,4-7,6. Охлаждают до +50 °C, добавляют 5 мл дефибринированной крови и, соблюдая стерильность, разливают в чашки Петри.
СРЕДА ТИНСДАЛЯ-САДЫКОВОЙ является селективной средой для дифтерийных бактерий. Посторонняя микрофлора на ней не растет или развивается очень скудно. Другим преимуществом среды является то, что она не нуждается в добавлении крови. Ее состав следующий: 100 мл мартеновского или обычного мясопептонного агара, 15-20 мл нормальной лошадиной сыворотки, 12 мл 1% раствора цистина (сначала растворить в 0,1 N р-ре NaOH, потом в воде), 11-12 мл 0,1N HCl (для нейтрализации NaOH); 1,8 мл 2% раствора теллуристого калия и 1,8 мл 2,5% раствора гипосульфита натрия.

Дифтерийные бактерии обладают рядом характерных биохимических признаков. Они хорошо ферментируют глюкозу и крахмал, высвобождают значительные количества активной цистиназы, выявляемой в пробе Пизу. Вместе с тем, названные микроорганизмы инертны в отношении сахарозы и не имеют фермента уреазы, обнаруживая отрицательную пробу Закса. Очень важным видовым признаком этих микробов является токсигенность. С эпидемиологической точки зрения, весьма существенное значение имеет серологическая неоднородность дифтерийных бактерий и наиболее широкое участие в распространении инфекции I и VI серологических типов. Это необходимо учитывать при диагностике дифтерии.

ОПРЕДЕЛЕНИЕ УГЛЕВОДОЛИТИЧЕСКОИ АКТИВНОСТИ дифтерийных бактерий производится на комплексе углеводных сред, состоящих из 1% пептонной воды с pH-7,6, в которую добавляют различные углеводы: 0,5% сахарозы, 0,5% глюкозы, 0,2% крахмала. В качестве индикатора используется реактив Андреде (кислый фуксин, обесцвеченный щелочью).
Среды разливают по 2 мл и стерилизуют текучим паром 3 дня подряд :по 30 минут. До работы они бесцветны, при ферментации углеводов — краснеют.
На углеводных сывороточно-водных средах, основа которых состоит из дистиллированной воды (80 мл) и сыворотки (20 мл), углеводолитические свойства культур проявляются плохо и ферментация углеводов идет очень медленно.
ОПРЕДЕЛЕНИЕ ПРОТЕОЛИТИЧЕСКИХ СВОЙСТВ
ПРОБА ПИЗУ — ОПРЕДЕЛЕНИЕ ФЕРМЕНТА ЦИСТИНАЗЫ
К 90 мл расплавленного 2% МПА с pH -7,6 добавляют 2 мл раствора цистина (1% раствор цистина в 0,1N растворе NaOH). Среду стерилизуют при +112 °C 30 минут. K расплавленной и охлажденной до +50 °C среде добавляют 1 мл 10% уксуснокислого свинца (простерилизованного дважды текучим паром) перемешивают и добавляют 9 мл нормальной лошадиной сыворотки. Среду стерильно разливают в маленькие пробирки по 2 мл. Посев производится уколом.
Вместо МПА с цистином можно использовать 2% МПА, приготовленный на переваре Хоттингера, с содержанием аминного азота в 250 мг%.
Дифтерийные бактерии активно перерабатывают белки и цистин с высвобождением сероводорода, который, соединяясь с уксусным свинцом, переходит в сернистый свинец коричнево-черного цвета. Дифтероиды подобных изменений не дают.
ПРОБА ЗАКСА — ОПРЕДЕЛЕНИЕ ФЕРМЕНТА УРЕAЗЫ
Проба Закса служит для отличия дифтериеподобных бактерий, обладающих уреазной активностью, от истинных дифтерийных палочек, не имеющих этого фермента.
- 1. ВАРИАНТ СРЕДЫ: к 100 мл МПБ или Хоттингеровского бульона добавляют 1 г мочевины и 0,2 мл 1,6% спиртового раствора крезолрот, разливают по 2-3 млв пробирки и стерилизуют текучим паром 10 минут. Результаты учитывают через 20-24 часа после посева. Покраснение среды свидетельствует о наличии уреазы.
- 2. ВАРИАНТ СРЕДЫ: готовят два реактива: А и В.
Реактив А: мочевина — 1 г, спирт 96°- 2 мл, дистиллированная вода — 4 мл.
Реактив В: 0,2% раствор фенолрота-1 мл, однозамещенный фосфат калия (КН2Р04)-0,1 г, двузамещенный фосфат калия (К2НРО4)-0,1 г, хлористый натрий — 0,5 г, дистиллированная вода — 100 мл.
Реактив А стерилизуют фильтрованием и хранят при + 4 °C, реактив В — в автоклаве текучим паром.
Перед работой оба реактива смешивают ex tempore из расчета 1 часть раствора А и 19 частей раствора В, смесь разливают по 0,1 мл в узкие пробирки. Испытуемые культуры вносят в количестве 2-6 капель, помещают в термостат на 30 минут. При положительной реакции смесь краснеет.
Дифференциация дифтерийных бактерий и дифтероидов по биохимическим признакам приведена ниже.
В отдельных случаях после определения биохимических свойств дифтерийных бактерий выясняется серотип штамма. Для этой цели используется ориентировочная агглютинация. Последнюю проводят на стекле с чистыми культурами, которые смывают со среды 1 мл солевого раствора и осторожно набирают стерильной пастеровской пипеткой. Агглютинирующие монотииовые сыворотки (I, II, III, IV, VI серотипы) разводят 1:25 солевым раствором с pH-7,6 (к 100 мл дистиллированной воды прибавляют 3,0 NaOH и устанавливают pH-7,6, доливая 5% раствор Na2HPO4). Для контроля испытуемой культуры ставят реакцию с выше указанным солевым раствором без сыворотки.
Положительная реакция характеризуется быстрым появлением хлопьев агглютината (2-3 минуты), особенно заметных при учете реакции над вотеутым зеркалом.
Неиспользованную сыворотку запаивают в ампулу или переливают в стерильную пробирку.
Агглютинирующие сыворотки хранятся в сухом месте при температуре от +4° до +10 °C.
При использовании высушенных сывороток последние перед употреблением растворяют в стерильной дистиллированной воде (1 мл на ампулу). Срок годности сухой сыворотки не ограничен.
УСКОРЕННЫЕ МЕТОДЫ ДИАГНОСТИКИ
ТЕЛЛУРНТОВАЯ ПРОБА — КЛИНИЧЕСКАЯ
Тампоном, смоченным 2% раствором теллуровокислого калия в 40% глицерине (выпускается в ампулах), смазывают пораженные миндалины и слизистую. При наличии дифтерийных бактерий тампон чернеет сразу или после 2-4-часовой инкубации в термостате.
ОПРЕДЕЛЕНИЕ ТОКСИГЕННОСТИ ДИФТЕРИЙНЫХ БАКТЕРИИ
Определение токсигенности дифтерийных бактерий осуществляется биологическим (в специализированных лабораториях) и диффузионным (на плотных средах) методами.
Рекомендуемая литература:
- Профилактика дифтерии. Методические материалы для практических работников. М., 1961, стр. 37.
- Сборник официальных материалов по лабораторному делу. Книга первая. Медгиз, 1961, стр. 331-337.
- Сборник схем бактериологического исследования при некоторых инфекционных заболеваниях. Методическое пособие для врачей-курсантов заочников, под ред. проф. П. Н. Кашкина, Л., 1965, стр. 17-20.
- Дяченко С. С. Микробиологические методы диагностики инфекционных заболеваний. Киев, 1962, стр. 224,
- Пяткин К. Д., Трофимова Н. Д., Маркова Н. С. Руководство к практическим занятиям по медицинской микробиологии, 1962, стр. 219.
- Руководство по микробиологии, клинике и эпидемиологии инфекционных заболеваний, 1964, т. VI, стр. 375.
- Руководство по микробиологической диагностике инфекционных болезней под ред. Матвеева К. И. и Соколова М. И. 1964, стр. 422-430.
Источник: Мотавкина Н.С., Пьянова Р.Е. Микробиологическая диагностика некоторых капельных инфекций и токсоплазмоза. Методическая разработка для студентов. ВГМУ, 1973
Дифтерия — острое инфекционное заболевание, вызываемое дифтерийной палочкой (Corynebacterium diphtheriae), характеризующеесяместным фибринозным поражением слизистых оболочек рото- и носоглотки (diphthera – пленка), а также тяжелой интоксикацией с поражением сердечно-сосудистой, нервной системы и надпочечников. Лабораторная диагностика дифтерии осуществляется в соответствии со схемой 14.

 Схема 14.Микробиологическая диагностика дифтерии
Схема 14.Микробиологическая диагностика дифтерии

Микроскопический метод в настоящее время фактически не применяется из-за его низкой информативности в связи с субъективизмом учета и выполняется только по требованию лечащего врача. Микроскопии подвергают мазки, окрашенные по Граму, метиленовым синим, по Нейссеру (для выявления включений волютина). Дифтерийные палочки (Corynebacteriumdiphtheriae) при окраске по Нейссеру содержат полярно расположенные темно-синие, почти черные, включения волютина и располагаются в виде римских цифр V или Х, тогда как сходные с ними дифтероиды и ложнодифтерийные бактерии (Corynebacteriumpseudodiphtheriae) зерен волютина не имеют и располагаются в виде частокола. Разработан также метод прямого флюорохромирования дифтерийных палочек корифосфином, окрашивающим включения волютина в красно-коричневый цвет, а цитоплазму в зеленый или желтый цвет, что позволяет повысить эффективность бактериоскопического метода.
Бактериологический метод-основной метод диагностики дифтерии. Исследуемый материал засевают на одну из специальных питательных сред для культивирования дифтерийных палочек, наиболее часто на среду Клауберга (МПА с глицерином, дефибринированной кровью и теллуритом натрия, задерживающим рост сопутствующей непатогенной микрофлоры). На среде Клауберга Corynebacterium diphtheriae образует 2 типа колоний:
а) серовато-черного цвета с радиальной исчерченностью поверхности, напоминающие цветок маргаритки или розетку (биовар gravis);
б) черные, круглые, выпуклые колонии колонии за счет восстановления теллурита (биовар mitis).
В мазке из типичной для дифтерийной палочки колонии обнаруживают грамположительные палочки булавовидной формы, расположенные в виде римских цифр V или Х, содержащие зерна волютина (рис. 16). Оставшуюся часть колонии пересевают на кровяной МПА для выделения чистой культуры.
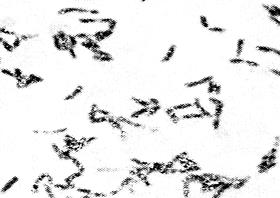
Рис. 16. Возбудитель дифтерии — Corynebacteriumdiphtheriae. Окраска по Нейссеру. Расположение в виде римских цифр V или Х, включения волютина по полюсам. х900
Идентификацию выделенной культуры проводят с учетом, прежде всего, ключевых свойств (токсигенность, наличие цистиназы). Токсигенность обычно определяют с помощью реакции преципитации в геле («чашечный» метод). Для этого в чашку Петри с питательной средой (МПА, 15—20 % лошадиной сыворотки, 0,3 % мальтозы, 0,03 % цистина) накладывают полоску фильтровальной бумаги, пропитанную антитоксической противодифтерийной сывороткой (5000 АЕ/мл), чашку подсушивают 30 минут в термостате, после чего засевают штрихами исследуемые культуры перпендикулярно полоске бумаги. В качестве контроля используют токсигенную культуру. Посевы инкубируют в термостате при 37 0 С в течение 18-20 часов. При наличии токсигенности в местах соединения токсина с антитоксическими антителами в питательной среде образуются белые линии преципитата, напоминающие усики. Для определения токсигенности дифтерийных бактерий также разработаны ИФА и ПЦР.
Цистиназу у выделенных культур (проба Пизу) определяют путем посева методом укола петли исследуемой культуры на цистиновый МПА с азотнокислым свинцом. Посевы помещают на сутки в термостат при 37 0 С. При наличии цистиназы в среде образуется почернение (образование сульфида свинца) по ходу укола, вокруг которого появляется коричневое облачко.
Выделенную культуру идентифицируют и дифференцируют от сходных с ней непатогенных коринебактерий по биологическим свойствам (табл. 16). Для определения уреазы петлю исследуемой культуры вносят в пробирку, содержащую спиртовый раствор мочевины и индикатор феноловый красный. Пробирку выдерживают 30 минут в термостате при 37 0 С, при наличии уреазы содержимое пробирки окрашивается в красный цвет.
При выделении нетоксигенной культуры ставят реакцию агглютинации с противодифтерийной сывороткой для выявления видового антигена Corynebacterium diphtheriae.
Серологический метод –РА, РНГА с целью определения антител в парных сыворотках крови больных дифтерией.
Таблица 16.Биологические свойства коринебактерий
| Вид | Волютин | Гемолиз | ферментация | токсин | цистиназа | уреаза | РА с ПДС | ||
| сахарозы | глюкозы | крахмала | |||||||
| C. diphtheriae биовар биовар | + + | — + | — | + + | + — | ± ± | + + | — — | + + |
| C.xerosis | ± | — | + | + | — | — | — | — | — |
| C. pseudodiphtheriae | ± | — | — | — | — | — | — | + | — |
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: При сдаче лабораторной работы, студент делает вид, что все знает; преподаватель делает вид, что верит ему. 9266 —  | 7276 —
| 7276 —  или читать все.
или читать все.
91.146.8.87 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
Дифтерийная палочка – возбудители дифтерии.
Дифтерия – острое инфекционное заболевание, характеризующееся токсическим поражением сердечно-сосудистой и нервной систем, а также специфическим фибринозным (дифтеритическим) воспалением в месте входных ворот.
Возбудитель был открыт в 1883 г. Клебсом, в 1884 г. Ф. Леффлер выделил его в чистой культуре. В 1888 г. Ру и Йерсен получили дифтерийный токсин, а в 1895 г. Беринг и Ру независимо друг от друга получили противодифтерийную сыворотку. В 1923 г. Рамон разработали технологию получения дифтерийного анатоксина, а позднее получил противодифтерийную сыворотку. Н.Г. Габричевский применил противодифтерийную сыворотку с лечебной целью и организовал ее производство в России.
Таксономия.
Вид – С. diphtheriae
В род Corynebacterium входят около 60 видов. Согласно Международной классификации Берджи этот род разделен на 3 секции:
1) патогенные для человека и животных;
2) патогенные для растений;
Морфология.
Прямые или слегка изогнутые палочки размером 0,3 — 0,6 х 4 — 8 мкм, спор не образуют, имеют микрокапсулу, неподвижны.
Особенностями дифтерийной палочки является наличие булавовидных утолщениях на концах; палочки отличаются также полиморфизмом; характерно взаимного расположения бактерий в мазках – в виде цифр V,X, L (не полное расхождение при делении);
В толстых мазках располагаются в виде «пучка булавок». Булавовидные утолщения на концах связаны с наличием зерен волютина (тельца Бабеша-Эрнста) – производные нуклеиновых кислот, метахроматиновые гранулы полиметафосфата. Бактерии могут образовывать фильтрующиеся и L-формы.
Грамположительные микроорганизмы. При окраске по методу Нейссера тело клетки окрашивается в синий цвет, а зерна волютина — в желтый. Метод Леффлера окрашивает цитоплазму в голубой цвет, а зерна волютина – в темно-синий.
Культуральные свойства.
Возбудители дифтерии — факультативные анаэробы, отимальная температура их культивирования 37 о С, рН 7,3-8,0. Требовательны к питательной среде, для роста необходимо наличие цистина, гистидина, фенилаланина, метионина и т.д. Факторами роста являются Са 2+ , Mg 2+ , Fe 2+ , Zn 2+ , Mn 2+ , Cu 2+ . Для культивирования применяют сывороточные (среда Леффлера), среды с добавлением крови, хинозальную среду Бучина. Дифференциально-диагностические среды: теллуритовая среда (Конради, Трох, 1913г.), глицериновокровяная среда с теллуритом (среда Клауберг ΙΙ), сывороточно-теллуритовый агар с цистином (Тиндаль), теллурит-шоколадный агар Маклеода.
На среде Леффлера бактерии растут в виде серовато-кремовых колоний, по типу «шагреневой кожи».
На теллуритовых средах возбудитель образует серовато-черные колонии, что обусловлено восстановлением теллурита до металлического теллура, имеющего черный цвет и аккумулирующегося бактериями.
Биохимическая активность.
Дифтерийные палочки малоактивны, сбраживают с образованием кислоты глюкозу, мальтозу, галактозу, декстрин, не разлагают сахарозу, лактозу, маннит, восстанавливают нитраты в нитриты. Не гидролизуют мочевину (проба Закса отрицательная), не образуют индол. Разлагают цистеин (проба Пизу положительная).
По культуральным, биохимическим, патогенетическим и некоторым другим свойствам дифтерийные палочки разделяются на 3 биовара.
1) биовар митис, характеризуется свойствами:
- ферментирует глюкозу, крахмал, мальтозу, не сбраживает сахарозу, гликоген, декстрин;
- обладает цистиназной активностью;
- восстанавливает нитраты;
- уреазная проба отрицательная;
- на средах с теллуритом образует мелкие гладкие блестящие черные колонии с ровным краем;
- на жидкой среде дает равномерное помутнение и порошкообразный осадок;
- дает зоны гемолиза на кровяных средах;
- малотоксичен;
- возбудители вызывают легкую спорадическую заболеваемость.
2) биовар гравис, характеризуется свойствами:
- ферментирует глюкозу, крахмал,декстрин, мальтозу,
- обладает цистиназной активностью;
- восстанавливает нитраты;
- уреазная проба отрицательная;
- на средах с теллуритом формирует крупные, сухие, матовые, плоские, серо-черные колонии, приподнятые в центре, с радиальной исчерченностью и неровным краем (напоминают маргаритку);
- на жидкой среде образуется пленка, помутнение, крошковидный или крупнозернистый осадок;
- дает гемолиз на кровяных средах;
· обладает выраженными токсигенными свойствами;
· выделяется от больных с тяжелой формой дифтерии, вызывает групповые вспышки.
3) биовар интермедиус, характеризуется свойствами:
· на средах с теллуритом образует мелкие сухие матовые серо-черные колонии с прозрачной периферией и неровным краем;
· на жидкой среде дает помутнение с последующим просветлением и образованием мелкозернистого осадка;
· гемолиз на кровяных средах отсутствует.
Антигенная структура.
Дифтерийная палочка имеет 2 антигена
1. О – антиген (групповой), полисахарид клеточной стенки, термостабильный, дает перекрестные реакции с микобактериями и нокардиями;
2. К – антиген (типовой), капсульный, термолабильный, иммуногенный, видоспецифичный.
На практике серотипирование не применяется, однако выпускаются диагностические сыворотки для РА, РПГА.
Для идентификации используют фаготипирование (22 фага) и бактериоцинотипирование (25 бактериоцинов).
Факторы патогенности.
Токсины. Палочка выделяет токсин – дифтерийный экзотоксин. По силе он занимает 3-е место после ботулинического и столбнячного. Термолабильный, высокотоксичный, иммуногенный, протективный, обладает анестезирующим действием. Гистотоксин обладает дермонекротическими, гемолитическими свойствами. Синтезируется в виде неактивного предшественника — единой полипептидной цепи с молекулярной массой 61 кД. Активируется под действием собственной протеазы, которая разрезает полипептид на 2 связанные между собой дисульфидными связями пептида: А (21 кД) и В (39 кД). Пептид В выполняет акцепторную функцию – распознает рецептор, связывается с ним, формирует внутримембранный канал, через который проникает в клетку пептид А. Пептид А – это фермент, который обеспечивает перенос аденозиндифосфатрибозы из НАД на один из аминокислотных остатков (гистидина) белкового фактора элонгации EF-2. В результате модификации EF-2 утрачивает свою активность, что приводит к подавлению синтеза белка рибосомами на стадии транслокации. Токсин синтезируют только С. diphtheriae, лизогенные умеренным конвертирующим tox-профагом, интегрирующимся с помощью сайт-специфической рекомбинации. Оперон, кодирующий синтез токсина имеет промотор tox Р и 3 участка: tox S, tox А, tox В. Тox S – обеспечивает выход токсина через мембрану в периплазматическое пространство бактериальной клетки. Утрата клеткой профага или мутации в tox-опероне делают клетку малотоксичной.
Ферменты патогенности: гиалуронидаза, нейраминидаза, фибринолизин, каталаза – факторы инвазии, лейкоцидин – обеспечивает устойчивость к фагоцитозу;
Структурные и химические компоненты клетки – пили (способствуют адгезии на чувствительных клетках), микрокапсула (обеспечивает устойчивость к фагоцитозу), корд-фактор (6-6-дифосфоэфир трегалозы, коринемиколовая и коринемиколиновая кислоты, обладающие нарушает фосфорилирование в митохондриях), бактериоцины (корицины) кодирование синтеза которых передается плазмидами.
Резистентность.
При нагревании до 60 о С палочки погибают за 10 мин, при 100 о С наступает мгновенная гибель. 5% раствор карболовой кислоты обеспечивает инактивацию через – 1 мин. Под действием прямого солнечного света палочка выживает несколько часов, в высохших пленках и кале – 3-4 мес., на предметах обихода и одежде сохраняется до 15 дней, на мягких игрушках – 3 мес., в воде и молоке – до 20 дней, в пыли – до 5 мес. Дифтерийные палочки чувствительны к пенициллину, тетрациклину, эритромицину.
Эпидемиология.
Источник инфекции – больной человек, носитель или реконвалесцент.
Механизмы передачи инфекции:
– аэрогенный (пути — воздушно-капельный и воздушно-пылевой);
– контактный (путь — непрямой контактный).
Больной опасен (в смысле заражения) с последних дней инкубационного периода.
Входные ворота – слизистые оболочки носа, зева, гортани, трахеи, бронхов, конъюнктивы глаз, наружных половых органов; раневая поверхность, пупочная рана.
Инкубационный период – 2-14-20 дней.
Патогенез.
Возбудители адсорбируются на чувствительных клетках, колонизируют эпителий. Секретируют гистотоксин, который инициирует развитие местного фибринозного воспаления, некроз эпителия, паретическое расширение сосудов с нарушением их проницаемости, отек тканей и выход фибриногена из сосудов. Фибриноген под влиянием тканевого тромбопластина, некротизированных тканей и атмосферным кислородом свертывается. На поверхности образуется фибринозная пленка. На многослойном плоском эпителии — плотная, спаянная с прилежащими тканями; на однослойном – тонкая, легко снимается. Разрастание пленок в воздухоносных путях может привести к асфиксии (истинный круп). Процесс сопровождают регионарные лимфадениты. Системное действие токсина приводит к гемодинамическим нарушениям. Развивается токсический миокардит и ранний паралич сердца. Возможно поражение канальцевого аппарата почек, некроз коркового слоя. В нервной системе – цитолиз нервных клеток с развитием поздних параличей мягкого неба, диафрагмы, сердца, блуждающего нерва. Смерть при дифтерии может наступить от раннего или позднего паралича сердца и диафрагмы, а также в результате истинного крупа (закупорки дыхательных путей оторвавшимися пленками).
У детей грудного возраста чаще развивается дифтерия зева (насмокр, слабая выраженность общих проявлений). Необходимо осматривать пупочную ранку для исключения местного процесса.
Иммунитет.
После перенесенного заболевания развивается стойкий напряженный антитоксический и мало выраженный антимикробный иммунитет. Возможно развитие носительства (10%) и повторное заражение (6-8%). Уровень иммунитета можно установить в РПГА. Диагностические – титры — 1:200 и выше. С той же целью применяется реакция Шика – внутрикожное введение микродоз дифтерийного токсина (1/40 Dlm 0,2 мл) внутрикожно. Через 48 ч появляется покраснение и инфильтрат, что свидетельствует об отсутствии антитоксических антител; при их наличии реакция не возникает. Из-за опасности сенсибилизации организма эту пробу проводят редко.
Микробиологическая диагностика.
Исследуемый материал – слизь из зева, носа, пленки с миндалин, раневое отделяемое, кровь
1. Бактериоскопический метод – микроскопия мазков из исследуемого материала (окраска по Граму, Нейссеру, Леффлеру).
2. Бактериологический метод – выделение чистой культуры возбудителя и ее идентификация. Необходимо не только выделить из исследуемого материала дифтерийную палочку, но и определить ее токсигенность.
Определение токсигенности С. dphtheriae:
а) биологическая проба на животных – внутрикожное заражение морских свинок фильтратом культуры дифтерийных бактерий – вызывает некроз в месте введения. Минимальная смертельная доза (20-30 нг) убивает морскую свинку на 4-5 день;
б) заражение куриных эмбрионов (наблюдается гибель под действием токсина);
в) внесение в культуру клеток ( выявление ЦПД);
г) метод твердофазного ИФА с меченными пероксидазой антителами;
д) использование ДНК-зонда для обнаружения tox-оперона в геноме;
е) тест Илека и Оухтерлони (1948 г.) – основу составляет способность токсина и антитоксина диффундировать в агар и образовывать преципитаты (усы, стрелы) по ходу диффузии – метод двойной преципитации в геле, предварительный ответ может быть выдан через 48 часов, через 72 часа – заключение о наличии токсигенных коринебактерий, через 96 часов – окончательный ответ.
3. Серодиагностика – РПГА, ИФА, РИА, реакция ко-агглютинации, реакция Шика.
4. Экспресс – диагностика – РИФ, ИФА, РПГА, реакция ко-агглютинации.
5. Биохимический и молекулярно-биологический метод – ПЦР (обнаружение tox-гена).
