Повышенный уровень ph
Содержание:
Что такое pН воды и почему важно его знать
Уровень активности ионов водорода в воде является одним из важнейших факторов, влияющих на оценку качества жидкости. Именно от данного критерия зависит уровень кислотно-щелочного баланса и направленность биохимических реакций, которые будут происходить в организме после употребления этой жидкости. В данной статье мы подробнее остановимся на вопросе, что такое pН воды, каким образом его определяют, а также же как повысить или понизить pН воды.
Из этой статьи вы узнаете:
Что такое pН воды
Какова норма pН воды
Чем грозит низкий уровень pH воды
Как измерить pН воды
Что такое pН воды
Показатель pH является единицей активности иона водорода, которая равна обратному логарифму активности водородных ионов. Так, например, вода, pH которой составляет 7, обладает 10–7 моль на один литр ионов водорода. Следовательно, жидкость с pH равном 6 – 10–6 моль на один литр. Шкала показателей pH при этом варьирует в диапазоне от 0 до 14. Если pH воды менее 7, то она является кислой, а если более 7 – тогда щелочной. Норма pH для поверхностных водных систем составляет 6,5–8,5, для подземных – 6–8,5.
Показатель pH воды равняется 7 при 25 °С, но при взаимодействии с диоксидом углерода в атмосфере данное значение будет составлять 5,2. Уровень pH тесно связан с атмосферным газом и температурой, поэтому воду следует проверить в самые короткие сроки. pH воды не сможет дать полной характеристики и повода для ограничения подачи воды.
Когда в воде растворяются различные химические вещества, то данный баланс подлежит изменению, что, в свою очередь, провоцирует изменение показателя pH. Если в воду добавить кислоту, концентрация ионов водорода возрастает, и концентрация гидроксид-ионов, в свою очередь, понижается. Если в жидкость добавить щелочь, тогда концентрация гидроксид-ионов возрастает, а содержание ионов водорода понижается.
Статьи, рекомендуемые к прочтению:
Уровень pН воды показывает уровень кислотности или щелочности среды, а кислотность и щелочность характеризуется количественным содержанием в воде элементов, нейтрализующих щелочь и кислоту. Так, например, температура отражает уровень нагрева вещества, но не количественный показатель тепла. Если мы коснемся воды рукой, то мы определим, теплая она или холодная, но мы не сможем сказать, какое количество тепла в ней содержится (другими словами, сколько потребуется времени для того, чтобы вода остыла).
Показатель pH – один из основных качественных характеристик воды. Он отражает кислотно-щелочной баланс и определяет, каким образом будут происходить те или иные биологические и химические процессы. Величиной pH воды определяется скорость протекания той или иной химической реакции, уровень коррозионной агрессивности жидкости, степень токсичности загрязняющего вещества и многие другие факторы. Более того, кислотно-щелочной баланс среды организма определяет наше состояние здоровья, настроение и самочувствие.
Различают следующие группы воды, в зависимости от показателя pH:
Контролировать уровень pН воды необходимо на каждом этапе очистки жидкости, поскольку смещение баланса может негативно отразиться на вкусовых качествах, запахе и оттенке воды, а также снизить эффективность ее очистки.
Каков нормальный pН воды
Из-за стремительного темпа современной жизни, неправильного питания, нарушения пищевого и питьевого режимов уровень pН в организме человека падает. Так, кислотно-щелочной баланс смещается в сторону повышенной кислотности (pН до значения 7 подразумевает кислую среду, и до 14 – щелочную, соответственно, чем ниже данный уровень, тем выше кислотность), что может привести к серьезным заболеваниям. Решать эту проблему можно с помощью ежедневного употребления минеральной воды с оптимальным уровнем активности ионов водорода. Именно поэтому важно знать, какая величина pН является нормой для воды, которую вы регулярно употребляете в пищу.

Итак, какой должен быть pН воды? Профессионалы утверждают, что эта величина должна ориентировочно соответствовать нормальному показателю pН крови человека (7,5). Именно поэтому для питьевой воды норму pН рассчитывают от 7 до 7,5. Благодаря чистой питьевой воде с нормальным показателем активности ионов водорода улучшаются обменные процессы в организме, увеличивается общая продолжительность жизни и оптимизируется обмен кислорода. И наоборот, из-за сладких, газированных и содержащих красители напитков уменьшается pН человеческой крови, что можно сразу заметить по неприятной сухости во рту.
Поэтому лучше всего отдавать предпочтение воде с «правильным» показателем pН. Вы всегда сможете найти эту информацию на этикетке любой бутылки. Никакой фильтр с наполнителями и абсорбентами не сможет заменить настоящую природную воду с оптимальным уровнем pН. Некоторые пытаются понизить кислотность воды pН и придать жидкости полезные свойства, добавляя лимонный или огуречный сок, тем не менее это далеко не всегда оказывает должный эффект. Еще один известный способ изменения pН воды – это электролиз, который позволяет получить в двух емкостях щелочную и кислую воду. Щелочная вода с высоким pН считается «живой», ее используют для лечения, а кислая – «мертвой», которую чаще всего используют для умывания.
Тем не менее такие способы не подойдут для ежедневного использования. В этой ситуации остается только одно рациональное решение – отдать предпочтение слабоминеральной природной воде с необходимым для здоровья уровнем кислотности.
Измерение pН воды
Не стоит забывать о том, что человеческий организм на целых 70 % состоит из воды! Продукты обмена веществ в клетках представляют собой кислоты, в то время как основная масса внутренних жидкостей организма, за исключением желудочной кислоты, слабощелочные. Особое значение при этом имеют показатели крови. Организм человека нормально функционирует, если его кровь слабощелочная, и величина ее pН составляет от 7,35 до 7,45.
В том случае, когда в кровь и межклеточную жидкость попадает большое количество кислот, происходит нарушение кислотно-щелочного баланса. Даже небольшое отклонение уровня pН от данных показателей (от 7,35 до 7,45) может привести к серьезному нарушению здоровья. Если продолжается процесс повышения кислотности крови и дальнейшее понижение значения pН до 6,95, то наступает кома и возникает настоящий риск для жизни человека! Именно по этой причине необходимо отслеживать величину pН питьевой воды, которая является одной из важнейших показателей ее качества!
Уровень pН воды вы сможете определить самостоятельно, в домашних условиях. В качестве прибора для измерения pН воды вы можете использовать лакмусовую (индикаторную) бумагу, которая меняет свой оттенок при кратковременном погружении в изучаемую среду. Так, при погружении в кислотную среду лакмусовая полоска приобретает красный оттенок, а в щелочную – синий. Далее следует сравнить получившийся цвет с цветной шкалой, в которой для каждого оттенка соответствует конкретный уровень pН, чтобы определить данный показатель у исследуемой жидкости. Данный метод определения pН является самым простым и дешевым.
Для наиболее точного определения уровня pН используют pН-метр для воды. Данный прибор для определения pН воды более дорогостоящий, чем лакмусовая бумага, тем не менее он определяет уровень pН жидкости в точности до сотых!
РН-метры для воды бывают бытовыми (портативными) и лабораторными. Чаще всего используют первый вариант, мы остановимся на них подробнее. Они различаются:
Степенью защиты от воды.
Наличием (или отсутствием) автоматической калибровки.
Последний параметр определяется количеством калибруемых точек (1 или 2). Точками называют буферные растворы, с помощью которых и производят калибровку РН-метра. Рекомендуем приобрести прибор с автоматической калибровкой.
Существуют специальные тест-полоски, определяющие уровень pН-среды. Такие полоски очень удобны в использовании. Их упаковка оснащена шкалой, с помощью которой определяют концентрацию водородных ионов. Но такие тест-полоски не так часто появляются в продаже, при этом они довольно дорогостоящие.
При всех своих преимуществах pН-метры для воды также отличаются сравнительно высокой ценой.
Вы можете воспользоваться самодельными тест-полосками, чтобы определить pН воды.
Существуют различные вещества, которые меняют свой цвет в зависимости от содержания водородных ионов в жидкости. Например, чай вместо коричневого оттенка приобретает желтый, если в него добавить ломтик лимона.
Таким же образом меняют свой цвет, в зависимости от содержания водородных ионов, вишневый, смородинный соки и т. д. В природе существует огромное количество таких органических индикаторов. И на основе таких индикаторов создают самодельные тест-полоски, которые позволяют определить pН воды.
Мы воспользуемся веществом, входящим в состав красной цветной капусты. Данный овощ содержит пигмент anthocyanin, относящийся к категории флавоноидов. Именно он отвечает за оттенок сока капусты и меняет его, в зависимости от уровня кислотности.
Антоцианы в кислой среде приобретают красный оттенок, а в щелочной – синий, в фиолетовый они окрашиваются, находясь в нейтральной среде. Аналогичными свойствами обладает и пигмент свеклы.
Для проведения эксперимента вам потребуется половина качана красной цветной капусты среднего размера, который следует мелко нарезать. Затем нарезанную капусту необходимо положить в емкость и залить литром воды. Затем вскипятите воду и оставьте данное зелье вариться в течение 20–30 минут.
За это время часть жидкости испарится, и вы получите отвар насыщенного фиолетового оттенка. Затем остудите зелье и приготовьте основу для теста.
Идеальным вариантом в этом случае послужит белая принтерная бумага, которая не будет вносить погрешности в цвет жидкости. Также ее преимущество заключается в том, что она хорошо впитывает отвар индикатора. Бумага должна быть нарезана полосками ориентировочно 1×5 см.
Перед тем как вы будете определять уровень pН воды, необходимо пропитать тест-полоски индикаторным раствором. Для этого процедите остывший отвар сквозь марлю и опустите в него бумагу. Следите за тем, чтобы тест-полоски пропитались равномерно. Пропитывать бумагу следует в течение 10 минут. В результате бумага должна приобрести бледно-сиреневый оттенок.
Далее просушите тест-полоски, разложив их на чистой бумаге или развесив на бельевой веревке.
Когда бумага, пропитанная отваром, высохнет, вы можете приступать к определению уровня pН воды. Затем сложите тест-полоски в коробку или полиэтиленовый пакетик, чтобы уберечь их от влаги.
Использовать данный метод определения уровня pН очень легко. Возьмите пипетку и капните одну-две капли испытуемого раствора на тест-полоску. Подождите одну-две минуты, чтобы индикатор вступил в реакцию с бумагой. В зависимости от показателя pН воды бумага приобретет определенный оттенок, который следует сравнить с цветной шкалой, имеющей следующий вид:
Водоро́дный показа́тель, pH (лат. pondus Hydrogenii [1] — «вес водорода»; произносится «пэ-аш») — мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, количественно выражающая его кислотность. Равен по модулю и противоположен по знаку десятичному логарифму активности водородных ионов, выраженной в молях на один литр:
pH = − lg [ H + ] <displaystyle <mbox
ight]>
Содержание
История [ править | править код ]
Это понятие было введено в 1909 году датским химиком Сёренсеном. Показатель называется pH, по первым буквам латинских слов potentia hydrogeni — сила водорода, или pondus hydrogeni — вес водорода. Вообще в химии сочетанием pX принято обозначать величину, равную −lg X . Например, силу кислот часто выражают в виде pKa = −lg Ka .
В случае pH, буква H обозначает концентрацию ионов водорода (H + ), или, точнее, термодинамическую активность гидроксоний-ионов.
Уравнения, связывающие pH и pOH [ править | править код ]
Вывод значения pH [ править | править код ]
В чистой воде концентрации ионов водорода ([H + ]) и гидроксид-ионов ([OH − ]) одинаковы и при 22 °C составляют по 10 −7 моль/л, это напрямую следует из определения ионного произведения воды, которое равно [H + ] · [OH − ] и составляет 10 −14 моль²/л² (при 25 °C).
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. При добавлении к воде кислоты концентрация ионов водорода увеличивается (на самом деле увеличивается не концентрация собственно ионов — иначе как способность кислот «присоединять» ион водорода могла бы приводить к этому — а концентрация именно таких соединений с «присоединённым» к кислоте ионом водорода), а концентрация гидроксид-ионов соответственно уменьшается, при добавлении основания — наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает. Когда [H + ] > [OH − ], говорят, что раствор является кислотным, а при [OH − ] > [H + ] — осно́вным.
Для удобства представления, чтобы избавиться от отрицательного показателя степени, вместо концентрации ионов водорода используют её взятый с обратным знаком десятичный логарифм, который, собственно, и является водородным показателем — pH.
pH = − lg [ H + ] <displaystyle < ext
ight]>
pOH [ править | править код ]
Несколько меньшее распространение получила обратная pH величина — показатель осно́вности раствора, pOH, равная отрицательному десятичному логарифму концентрации в растворе ионов OH − :
как в любом водном растворе при 25 °C [ H + ] [ OH − ] = 1 , 0 ⋅ 10 − 14 <displaystyle [< ext
pOH = 14 − pH <displaystyle < ext
Значения pH в растворах различной кислотности [ править | править код ]
| Вещество | pH | Цвет индикатора |
|---|---|---|
| Геотермальная вода у вулкана Даллол | ≈ 0 | |
| Электролит в свинцовых аккумуляторах | [2] | |
| Чистая вода при 25 °C | 7,0 | |
| Кровь | 7,36–7,44 | |
| Морская вода | 8,0 | |
| Мыло (жировое) для рук | 9,0–10,0 | |
| Нашатырный спирт | 11,5 | |
| Отбеливатель (хлорная известь) | 12,5 | |
| Концентрированные растворы щелочей | >13 |
Так как при 25 °C (стандартных условиях) [H + ] · [OH − ] = 10 −14 , то понятно, что при этой температуре pH + pOH = 14.
Так как в кислотных растворах [H + ] > 10 −7 , то у кислотных растворов pH 7, pH нейтральных растворов равен 7. При более высоких температурах константа электролитической диссоциации воды повышается, соответственно увеличивается ионное произведение воды, поэтому нейтральной оказывается pH + , так и OH − ); при понижении температуры, напротив, нейтральная pH возрастает.
Методы определения значения pH [ править | править код ]
Для определения значения pH растворов широко используют несколько методик. Водородный показатель можно приблизительно оценивать с помощью индикаторов, точно измерять pH-метром или определять аналитически путём, проведением кислотно-осно́вного титрования.
- Для грубой оценки концентрации водородных ионов широко используются кислотно-осно́вные индикаторы — органические вещества-красители, цвет которых зависит от pH среды. К наиболее известным индикаторам принадлежат лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и другие. Индикаторы способны существовать в двух по-разному окрашенных формах — либо в кислотной, либо в осно́вной. Изменение цвета каждого индикатора происходит в своём интервале кислотности, обычно составляющем 1-2 единицы.
- Для расширения рабочего интервала измерения pH используют так называемый универсальный индикатор, представляющий собой смесь из нескольких индикаторов. Универсальный индикатор последовательно меняет цвет с красного через жёлтый, зелёный, синий до фиолетового при переходе из кислотной области в осно́вную. Определения pH индикаторным методом затруднено для мутных или окрашенных растворов.
- Использование специального прибора — pH-метра — позволяет измерять pH в более широком диапазоне и более точно (до 0,01 единицы pH), чем с помощью индикаторов. Ионометрический метод определения pH основывается на измерении милливольтметром-ионометром ЭДС гальванической цепи, включающей специальный стеклянный электрод, потенциал которого зависит от концентрации ионов H + в окружающем растворе. Способ отличается удобством и высокой точностью, особенно после калибровки индикаторного электрода в избранном диапазоне рН, позволяет измерять pH непрозрачных и цветных растворов и потому широко используется.
- Аналитический объёмный метод — кислотно-осно́вное титрование — также даёт точные результаты определения кислотности растворов. Раствор известной концентрации (титрант) по каплям добавляется к исследуемому раствору. При их смешивании протекает химическая реакция. Точка эквивалентности — момент, когда титранта точно хватает, чтобы полностью завершить реакцию, — фиксируется с помощью индикатора. Далее, зная концентрацию и объём добавленного раствора титранта, вычисляется кислотность раствора.
- Влияние температуры на значения pH
0,001 моль/л HCl при 20 °C имеет pH=3, при 30 °C pH=3 [ источник не указан 1274 дня ]
0,001 моль/л NaOH при 20 °C имеет pH=11,73, при 30 °C pH=10,83 [ источник не указан 1274 дня ]
Влияние температуры на значения pH объясняется различной диссоциацией ионов водорода (H + ) и не является ошибкой эксперимента. Температурный эффект невозможно компенсировать за счет электроники pH-метра.
Роль pH в химии и биологии [ править | править код ]
Кислотность среды имеет важное значение для множества химических процессов, и возможность протекания или результат той или иной реакции часто зависит от pH среды. Для поддержания определённого значения pH в реакционной системе при проведении лабораторных исследований или на производстве применяют буферные растворы, которые позволяют сохранять практически постоянное значение pH при разбавлении или при добавлении в раствор небольших количеств кислоты или щёлочи.
Водородный показатель pH широко используется для характеристики кислотно-осно́вных свойств различных биологических сред.
Кислотность реакционной среды особое значение имеет для биохимических реакций, протекающих в живых системах. Концентрация в растворе ионов водорода часто оказывает влияние на физико-химические свойства и биологическую активность белков и нуклеиновых кислот, поэтому для нормального функционирования организма поддержание кислотно-осно́вного гомеостаза является задачей исключительной важности. Динамическое поддержание оптимального pH биологических жидкостей достигается благодаря действию буферных систем организма.
В человеческом организме в различных органах водородный показатель различен. Нормальный рН крови составляет 7,36, то есть кровь имеет слабоосновную реакцию (с колебаниями от 7,34 у венозной крови до 7,40 у артериальной). В зависимости от биохимических изменений в крови может наблюдаться ацидоз (увеличение кислотности) или алкалоз (увеличение осно́вности), однако совместимый с жизнью диапазон pH крови невелик, поскольку уже при уменьшении pH до 6,95 наступает потеря сознания, а смещение реакции крови в щелочную сторону до pH = 7,7 вызывает тяжелейшие судороги. Поддержание кислотно-основного баланса крови в допустимых пределах осуществляется буферными системами крови, главной из которых является гемоглобиновая [3] . Нормальный водородный показатель желудочного сока (в просвете тела желудка натощак) равен 1,5…2,0 [4] . У сока тонкой кишки pH в норме составляет 7,2…7,5, при усилении секреции достигает 8,6. У сока толстой кишки в норме pH равен 8,5…9,0 [5] .
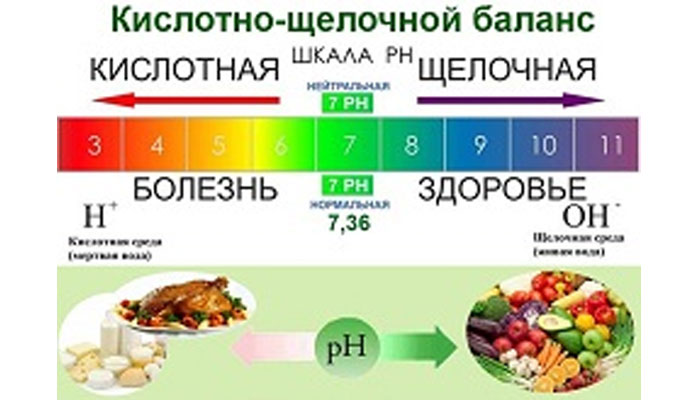
Можете ли вы себе представить, что развитие многих болезней зависит от одной причины? Многие специалисты диетологи и фитотерапевты эту скрытую опасность теперь обозначают двумя словами: кислота и щелочь.
Высокая кислотность разрушает наиважнейшие системы в организме, и он становится беззащитен перед болезнями. Сбалансированная pH-среда обеспечивает нормальное протекание метаболических процессов в организме, помогая ему бороться с заболеваниями. Здоровый организм имеет запас щелочных веществ, которые он использует в случае необходимости.
Что такое pH?
Соотношение кислоты и щелочи в каком-либо растворе называется кислотно-щелочным равновесием (КЩР), хотя физиологи считают, что более правильно называть это соотношение кислотно-щелочным состоянием. КЩР характеризуется водородным показателем pH (от лат. pondus Hydrogenii — «вес водорода», произносится «пэ аш»), который показывает число водородных атомов в данном растворе.
Значение показателя pH зависит от соотношения между положительно заряженными ионами (формирующими кислую среду) и отрицательно заряженными ионами (формирующими щелочную среду).
PH — это мера относительной концентрации водородных (Н+) и гидроксильных (ОН—) ионов в жидкой системе и выражается в масштабе от 0 (полное насыщение ионами водорода Н+) до 14 (полное насыщение гидроксильными ионами ОН—), дистиллированная вода считается нейтральной с рН 7,0.
0 — сильнейшая кислота, 14 — сильнейшая щелочь, 7 – нейтральное вещество.
Зачем нам знать о pH?
Тело человека на 80% состоит из воды, поэтому вода – это одна из наиболее важных его составляющих. Поэтому от того, какой водородный показатель (pH) будет у этой воды, зависит, насколько здоровы мы будем.
При pH равном 7,0 говорят о нейтральной среде. Чем ниже уровень pH – тем среда более кислая (от 6,9 до 0). Щелочная среда имеет высокий уровень pH (от 7,1 до 14,0).
Организм человека постоянно стремится уравновесить это соотношение, поддерживая строго определенный уровень pH. При нарушенном балансе могут возникать множество серьезных заболеваний.
Если в любой из жидкостных сред организма происходит повышение концентрации (Н+) ионов, то возникает смещение pH в кислую сторону, то есть, происходит закисление среды. Это называется ещё кислотным сдвигом.
И наоборот — повышение концентрации (ОН-) ионов вызывает смещение значения pH в щелочную сторону, или щелочной сдвиг.
Наш организм имеет слабощелочную среду. Кислотно-щелочной баланс в нашем организме постоянно поддерживается на одном стабильном уровне и в очень узком диапазоне: от 7,26 до 7,45. И даже незначительное изменение рН крови, выходящее за эти границы, может привести к болезням.
Повышенная кислотность в организме.
Из-за неправильного питания и употребления в пищу кислых продуктов, а также недостатка воды происходит закисление организма. Люди употребляют много жиров, мяса, молочных продуктов, зерновых культур, сахара, мучных и кондитерских изделий, всевозможных полуфабрикатов и других переработанных, рафинированных продуктов, практически не содержащих клетчатки, минералов и витаминов, не говоря уже о ферментах и ненасыщенных жирных кислотах.
Для того, чтобы противостоять этому – снизить концентрацию кислоты и удалить ее от жизненно важных органов – организм задерживает воду, что отрицательно влияет на обмен веществ: организм быстрее изнашивается, кожа становится сухой, морщинистой.
К тому же при закисленности организма ухудшается перенос кислорода к органам и тканям, организм плохо усваивает минералы, а некоторые минералы, такие как Ca, Na, K, Mg выводятся из организма.
Организму приходится тратить колоссальное количество ресурсов и энергии на нейтрализацию лишних кислот, вызывая тем самым определённый дисбаланс в биохимических реакциях.
Так как щелочных резервов, поступающих извне, явно не хватает, то организм вынужден задействовать свои внутренние ресурсы — кальций, магний, железо, калий. В результате снижается гемоглобин, развивается остеопороз.
Когда железо гемоглобина крови используется для нейтрализации кислоты, человек ощущает усталость.
Если на эти нужды расходуется кальций, появляется бессонница, раздражительность.
Вследствие снижения щелочного резерва нервной ткани нарушается умственная деятельность.
От недостатка минералов страдают жизненно важные органы, повышается риск сердечно сосудистых заболеваний, снижается иммунитет, появляется хрупкость костей и многое другое.
Если в организме находится большое количество кислоты и нарушены механизмы ее вывода (с мочой и калом, с дыханием, с потом и т.д.), организм подвергается сильнейшей интоксикации.
К чему приводит повышенный уровень кислотности в организме?
В глобальном масштабе, закисление организма приводит к возникновению более чем 200(!) заболеваний, например: катаракты, дальнозоркости, артрозов, хондрозов, желче- и мочекаменной болезней, и даже онкологии.
Зная это, перестаешь удивляться, почему у человечества столько болезней, почему люди рано стареют и умирают.
Вдумайтесь: более 90% пищи, которую мы едим — это «кислые» продукты, и всё, что мы пьем (кроме чистой воды, свежевыжатых соков и травяного чая без сахара) — имеет pH от 4,5 до 2,5 — то есть ещё больше закисляет наш организм.
Состояние повышенной кислотности называется — Ацидоз. Не выявленный вовремя ацидоз может вредить организму незаметно, но постоянно в течение нескольких месяцев и даже лет. Злоупотребление алкоголем часто приводит к ацидозу. Ацидоз может возникать, как осложнение диабета.
При Ацидозе могут появиться следующие проблемы:
- Заболевания сердечно-сосудистой системы, включая стойкий спазм сосудов и уменьшение концентрации кислорода в крови, сердечная недостаточность, ослабление сердечной мышцы.
- Прибавление в весе и диабет.
- Заболевания почек и мочевого пузыря, образование камней.
- Проблемы с пищеварением, ослабление гладких мышц кишечника и так далее.
- Снижение иммунитета.
- Общая слабость.
- Увеличение вредного воздействия свободных радикалов, которые могут способствовать онкогенезу.
- Хрупкость костей вплоть, до перелома шейки бедра, а также других нарушениях опорно-двигательного аппарата, как например, образование остеофитов (шпор).
- Появление суставных болей и болевых ощущений в мышцах, связанных с накоплением молочной кислоты.
- Постепенное ослабление работы глазных мышц, развитие дальнозоркости, которая очень распространена среди пожилых людей.
- Снижение выносливости и способности восстанавливаться после физической нагрузки.
В течение 7 лет, проводилось исследование в Калифорнийском Университете (штат Сан-Франциско), где были обследованы 9 тыс. женщин. Результаты показали, что при постоянном повышенном уровне кислотности кости становятся ломкими.
Специалисты, проводившие этот эксперимент, уверены, что большинство проблем женщин среднего возраста связано с излишним употреблением мяса и молочных продуктов и недостатком употребления в пищу овощей, фруктов и зелени. Поэтому организму ничего не остается, как забирать кальций из собственных костей, и с его помощью регулировать уровень рН.
Как организм управляет уровнем кислотности?
- Выделяет кислоты — через желудочно-кишечный тракт, почки, легкие, кожу;
- Нейтрализует кислоты — с помощью минералов: кальций, магний, калий, натрий;
- Накапливает кислоты — в тканях, прежде всего в мышцах.
Отто Варбург потратил 24 года своей жизни на то, чтобы доказать тот факт, что в среде, насыщенной кислородом, при pH 7,43 и выше (слабощелочная среда), раковые клетки не размножаются. В 1931 году он получил за это Нобелевскую премию по химии. А его ученики позже доказали, что в этой среде НЕ развиваются паразиты, вирусы, бактерии и грибки.
Что делать, если pH-баланс в норме?
Ответ простой – способствовать сохранению этого баланса в здоровой зоне.
Как это сделать?
Постоянно контролировать, что мы едим, что мы пьем, насколько мы чистые изнутри и как мы защищаем свой организм от вредных воздействий.
Вода.
Необходимо пить достаточное количество правильной воды, а конкретно — 30 мл на килограмм веса в день (в жаркие летние месяцы можно в 2-3 раза больше).
Еда.
Если кислотно щелочное равновесие уже нарушено, то стоит задуматься о своем питании, и уменьшить потребление кислой еды (мясных и молочных продуктов, хлеба, сладостей, газированных напитков, любых искусственно созданных продуктов) и увеличить потребление ощелачивающих продуктов. Если нет возможности изменить состав питания, то стоит задуматься об употреблении «умной еды» (smart food) — нутрицевтиков, восполняющих недостаток поступающих с пищей витаминов, минералов, аминокислот, полиненасыщенных жирных кислот и растительных ферментов.
Также нельзя забывать о регулярном очищении организма, двигательной активности и психологии позитивного отношения к жизни. Все это — части концепции здоровья, просто и доступно объясняющей причины большинства заболеваний и показывающей возможности восстановления и поддержания здоровья.
Молодеть и становиться более здоровым с годами — это реально!
Почему важно поддерживать правильный рН-баланс?
Слабокислая среда нужна для запуска разнообразных химических процессов (например, пищеварение — в желудке среда немного смещена в сторону кислотности), а вот кровь слабокислой быть не должна — если баланс pH в крови изменить, то процессы пойдут не так, как задумано.
Ведь в крови находится весь наш строительный материал (передаваемый из печени), белки, антитела, тучные гены, лейкоциты, питательные вещества и куча всего другого. Они настроены на работу именно в таком диапазоне (7.35-7.45) и малейший сдвиг работу всей системы нарушает (кровь же повсюду, у нас 85000 км вен и артерий но при этом всего 5 литров крови).
Все регулирующие механизмы организма (включая дыхание, обмен веществ, производство гормонов) направлены на уравновешивания уровня pH, путем удаления едких кислотных остатков из тканей организма, не повреждая живые клетки. Если уровень pH становится слишком низким (кислым) или слишком высоким (щелочным), то клетки организма отравляют сами себя своими токсичными выбросами и погибают.
Важность баланса всей этой системы подчёркивает ещё и такой факт: чтобы сохранить баланс между кислотой и щелочью, организм берёт кальций из костей (наш банк кальция) и магний (они с кальцием неразрывно связаны), чтобы ощелачивать кислоту.
Что делать хроникам?
Даже «самая правильная» программа питания, либо программа лечения каких либо болезней не будет эффективно работать, если ваш рН-баланс организма нарушен.
Постоянная нагрузка на компенсаторные системы организма в течение многих лет и десятилетий сильно вредит организму, изнашивает его. Постепенно и неуклонно происходит перекос в работе всех систем и обменных процессов.
Это не может продолжаться бесконечно и без последствий. Возникающие на этом фоне хронические заболевания просто невозможно вылечить с помощью медикаментов.
Здесь единственным и самым лучшим «лекарством» может быть только одно: полностью перестроить режим питания, ликвидировать кислотную нагрузку, питаться преимущественно сырой растительной пищей в течение многих лет — до тех пор, пока все функции, все процессы в организме не вернутся к нормальным параметрам и исчезнет дисбаланс.
Если человек понимает важность пересмотра питания, но по каким-то причинам у нег не получается строго следовать подобной диете, то в этом случае можно использовать ощелачивающие добавки к пище (smart food).
Чтобы жить полноценной, здоровой жизнью, единственный выход – это ощелачивание организма.
То, как мы будем это делать, зависит полностью от нашего выбора. Кто-то сможет полностью следовать советам по изменению пищевого рациона и станет веганом или сыроедом. А кто-то (как я, например) столкнется с тем, что для него это сложно.
И тогда возникнет вопрос:
А ЧТО ЖЕ ДЕЛАТЬ МНЕ, ОБЫЧНОМУ ЧЕЛОВЕКУ?
Я выбрала для себя систему восстановления кислотно-щелочного равновесия от Кораллового Клуба (Coral Club) и достаточно долгий срок с успехом применяю ее в своей жизни. За это время мой организм изменился и внешне, и внутренне.
Подробнее самой простой и безопасной программе ощелачивания здесь.
Если Вас заинтересовала эта система и Вы хотите узнать о ней больше или начать применять ее как можно скорее — свяжитесь со мной любым удобным для Вас способом, чтобы получить подробную консультацию.
